Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Сравнение кислотности и основности в разных растворителяхОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Сравнение кислотности и основности в разных растворителях Сравнение кислотности и основности в разных растворителяхСтраница 2
В этом аспекте очень ценными являются так называемые диполярные апротонные растворители, например диметилсульфоксид (ДМСО) или диметилформамид (ДМФА), HCON(CH3)2. Эти жидкости хорошо растворяют полярные молекулы и соли, и с то же время гораздо менее кислотны и основны, чем вода и другие гидроксильные растворители.
Влияние диэлектрической проницаемости растворителя на кислоты разного зарядового типа. Особенно ярко влияние растворителя проявляется, если сравниваются между собой по-разному электрически заряженные кислоты. Из табл. 3.4 видно, что в воде дихлоруксусная кислота в 16 раз сильнее иона тринитроанилиния, а в метаноле и ДМСО ион анилиния в 3-4×103 раз сильнее дихлоруксусной кислоты. В воде уксусная кислота почти в 3 раза сильнее иона пиридиния, а он, в свою очередь, в метаноле является в 12000 раз более сильной кислотой. Фенол в воде в 5 раз слабее иона аммония и в 5 раз сильнее иона триэтиламмония, но в метаноле фенол как кислота в 2500 раз слабее обоих ионов, а в ДМСО фенол в 8.105 раз слабее NH4+ и с 2,5.107 раз слабее (С2Н5)3NH+. Значение рКа замещенных ионов аммония не очень сильно изменяется при переходе от воды к метанолу или ДМСО, однако кислотность незаряженных ОН-кислот при этом уменьшается на 4-6 порядков. Это связано с влиянием диэлектрической проницаемости растворителя.
При диссоциации положительно заряженных ионов аммония образуется положительно заряженный ион протонированной молекулы растворителя (SH+), т.е. в правой и левой частях стехиометрического уравнения имеется по одному иону:
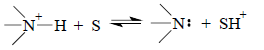
Однако для нейтральных кислот в правой части уравнения диссоциации имеются два, а в левой части - ни одного иона:

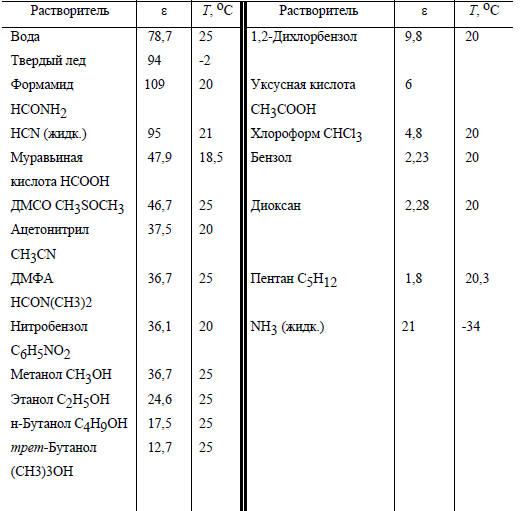
Следовательно, переход от растворителя с высокой диэлектрической проницаемостью (вода) к менее полярным средам (метанол, ДМСО) должен сильно уменьшать кислотность нейтральных кислот и оказывать сравнительно малое влияние на заряженные кислоты. В табл. 3.6 приведены диэлектрические проницаемости некоторых широко используемых в практике растворителей.
Таблица 3.6
Относительные диэлектрические проницаемости (ε; для вакуума ε=1) некоторых растворителей
Специфическая сольватация анионов. Зарядный тип кислоты играет очень важную роль во влиянии растворителя на кислотность. Однако кислоты даже одинакового заряда могут сильно отличаться по относительной кислотности в двух разных растворителях. Например, при переходе от метанола к ДМСО кислотная сила фенола убывает в 160 раз, но кислотность 2,4,6-тринитрофенола (пикриновой кислоты) возрастает в 13 000 раз (см. табл. 3.5).
Эти наблюдения нельзя объяснить ни влиянием основности растворителя (основность метанола и ДМСО практически одинакова; см. табл. 3.3), ни влиянием диэлектрической проницаемости, так как сравниваются две кислоты одинакового зарядного типа. Можно полагать, что наблюдаемое различие, по крайней мере частично, связано со способностью растворителя образовывать водородные связи с анионами фенола и пикриновой кислоты. Образование водородных связей между растворителем и растворенным веществом является одним из главных видов специфической сольватации. Термин "специфическая сольватация" используется для того, чтобы отличить сольватацию, включающую сильные химические взаимодействия между растворителем и растворенным веществом, от так называемой "физической сольватации", при которой не очень важны молекулярные свойства среды, и ее можно рассматривать как континуум, имеющий определенную диэлектрическую проницаемость. В разделе 2.3.1 (гл. 2) отмечалось, что водородная связь образуется, как правило, между электроотрицательными атомами. В общем, способность элементов образовывать водородные связи убывает в ряду:
Смотрите также
Действие алкоголя на организм человека
...
Реакции спиртов. Кислотно-основные свойства спиртов. Реакции с участием нуклеофильного центра
Спирты представляют собой соединения
общей формулы ROH, в которых гидроксильная группа присоединена к насыщенному
атому углерода. По номенклатуре ИЮПАК насыщенные спирты называют алканолами, ...


