Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Сравнение кислотности и основности в разных растворителяхОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Сравнение кислотности и основности в разных растворителях Сравнение кислотности и основности в разных растворителяхСтраница 1
Изменение кислотности и основности при переходе от одного растворителя к другому связано с различными причинами, из которых главными являются: 1) различие кислотно-основных свойств растворителей, 2) различие в их полярности, 3) специфическая сольватация молекул и ионов. В данном разделе будут приведены некоторые примеры, иллюстрирующие принципы подхода к интерпретации влияния растворителя на кислотно-основное равновесие. Поскольку в большинстве случаев ΔН и ΔS неизвестны, мы будем опираться только на значение рКа.
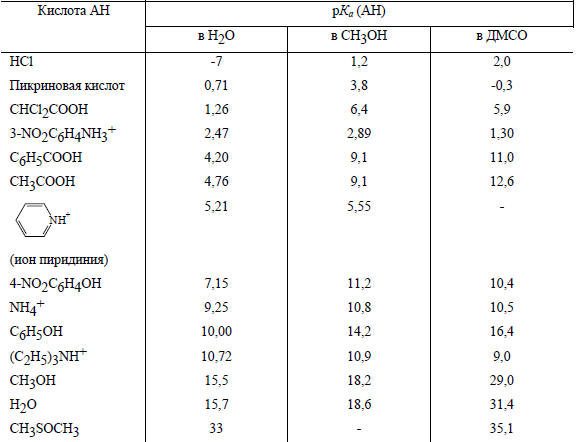
Влияние кислотно-основных свойств растворителя. Диапазон кислотности и основности в данной среде ограничен собственными амфотерными свойствами растворителя, т.е. "окном" между рКа (S) и (SН+) (символами S и SН+ обозначены свободная и протонированная молекулы растворителя). В воде кислоты рКа<≈~-2 полностью диссоциированы. Вода нивелирует силу сильных кислот, ибо она "слишком основна", чтобы дифференцировать их. Так, серная и соляная кислоты, отличающиеся по силе на 6 порядков (ΔрКа=6; см. табл. 3.2), в разбавленных водных растворах кажутся одинаково сильными (значения -3 и -7, приведенные в табл. 3.2, получены не прямыми измерениями, а путем косвенной оценки). В отличие от них моно- и дихлоруксусная кислоты, очень близкие по величине рКа (2,86 и 1,26 соответственно; см. табл. 3.2), сильно отличаются по степени диссоциации: в 0,1 М водном растворе первая диссоциирует на 11% (рН 1,96), а вторая - на 52% (рН 1,29). Такие близкие по рКа кислоты легко дифференцируются в воде по той причине, что они представляют собой более слабые кислоты, чем HCl или H2SO4.
В уксусной кислоте, которая как основание слабее воды (см. табл. 3.3), нацело диссоциирует только хлорная кислота, а HNO3 и HCl диссоциированы лишь в слабой степени. Таким образом, в слабоосновном растворителе HNO3 и HCl ведут себя как слабые кислоты.
В соответствии с этим слабые кислоты в воде могут полностью диссоциировать в более основном растворителе, например, в жидком аммиаке или в алкиламинах. В этих растворителях все кислоты, у которых в воде рКа<5, т.е. более сильные, чем уксусная кислота, кажутся одинаково сильными, так как полностью диссоциируют. Таким образом, когда кислоту называют сильной или слабой на основании величины рКа, определенной в воде, речь идет только о ее диссоциации в воде. В растворителях иной основности диссоциация будет другой. Некоторые данные по кислотности в разных растворителях приведены в табл. 3.5.
Растворитель соответствующим образом влияет также и на реакции оснований. Вода нивелирует силу оснований с рКа(ВН)>16. Поэтому NH2-K+, C2H5O-Li+ и CH3OCH2-Na+ будут реагировать с водой, образуя соответствующие сопряженные кислоты NH3, C2H5OH и CH3SOCH3 и стехиометрическое количество ОН-. Однако в менее кислотном растворителе, например C2H5NH2, основания, более сильные, чем ОН-, не будут протонироваться.
Если взять растворитель, более кислотный, чем вода, то основания, которые были слабыми в воде, будут эффективно протонироваться. Например, в H2SO4 слабо основные в воде ароматические амины почти полностью протонированы:

В серной кислоте даже такие соединения, как азотная кислота или карбоновые кислоты, являются основаниями:
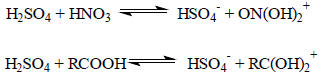
Таблица 3.5
Значения рК некоторых кислот в разных растворителях при 25оС (ДМСО - диметилсульфоксид)
В начале этого раздела было отмечено, что диапазон кислот и оснований, которые можно применять в данном растворителе, ограничивается степенью амфотерности растворителя. Если растворитель имеет низкую кислотность, то в нем будут проявлять свои основные свойства широкий круг оснований при условии, что они растворимы. Аналогично растворитель, не обладающий в заметной степени основными свойствами, не может нивелировать силу большого круга кислот, которые в нем будут проявлять свои истинные кислотные свойства. Однако жидкости, не обладающие ни кислотностью, ни основностью, вряд ли будут хорошими растворителями для кислот и оснований. Например, сильные (в воде) кислоты CH3SO3H или HNO3 и сильные (в воде) основания (CH3)3CO-K+ или NH=C(NH2)2 плохо растворимы в углеводородах - растворителях, не обладающих в заметной степени ни кислыми, ни основными свойствами.
Смотрите также
Роль алхимии в становлении химии
...
Исследование кинетики реакции
...
Разработка технологии полимеризационного наполнения ПКА дисперсными наполнителями
В
настоящее время рынок потребления высоконаполненных композиционных
магнитотвёрдых материалов, к которым относятся так называемые магнитопласты,
является одним из самых динамичных в промыш ...


