Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Жесткость - один из технологических показателей, принятых для
характеристики состава и качества природных вод.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Определение жесткости и умягчение
воды. / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Определение жесткости и умягчение
воды. / Жесткость - один из технологических показателей, принятых для
характеристики состава и качества природных вод. Жесткость - один из технологических показателей, принятых для
характеристики состава и качества природных вод.Страница 1
Жесткой называют воду с повышенным содержанием ионов ![]() и
и ![]() . Сумма концентраций ионов
. Сумма концентраций ионов ![]() и
и ![]() является количественной мерой жесткости воды;
является количественной мерой жесткости воды;
![]()
Измеряют жесткость числом милимолей эквивалентов ионов жесткости (![]() и
и ![]() ) в 1кг воды (ммоль/кг).
) в 1кг воды (ммоль/кг).
В связи с тем, что плотность воды близка к единице, жесткость можно измерять в ммоль/дм или ммоль/л,
При расчетах, связанных с жесткостью воды, следует учитывать, что
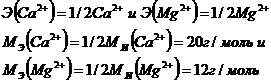
где ![]() - мольная масса эквивалента.
- мольная масса эквивалента.
![]() - мольная масса иона.
- мольная масса иона.
Например: 0,2г - это масса 0,01 моль или 10 ммоль эквивалентов ![]() . Различают жесткость воды общую Жо, карбонатную (временную) Жк и некарбонатную Жнк.
. Различают жесткость воды общую Жо, карбонатную (временную) Жк и некарбонатную Жнк.
В связи с тем, что в воздухе достаточно велико содержание ![]() , в природной воде есть растворимый диоксид углерода. Протекает взаимодействие
, в природной воде есть растворимый диоксид углерода. Протекает взаимодействие ![]() с
с ![]() :
:
![]() ,
,
результатом которого является образование гидрокарбонат-Иона. Концентрация ионов ![]() и
и ![]() в воде, эквивалентная содержанию иона НСО3, определяет карбонатную жесткость воды, а концентрация ионов
в воде, эквивалентная содержанию иона НСО3, определяет карбонатную жесткость воды, а концентрация ионов ![]() и
и ![]() , эквивалентная всем прочим анионам (SO4,
, эквивалентная всем прочим анионам (SO4, ![]() и т.д.), - некарбонатную. Сумма карбонатной и некарбонатной жесткости составляет общую жесткость воды.
и т.д.), - некарбонатную. Сумма карбонатной и некарбонатной жесткости составляет общую жесткость воды.
Таким образом, временная жесткость воды вызывается присутствием гидрокарбонатов - Са(НСО3)2, Mg(НСО3)2 постоянная жесткость вызвана присутствием в воде сульфатов и хлоридов ![]() и
и ![]() .
.
При контроле качества воды определяют ее жесткость. Для определения общей жесткости используют метод комплексонометрии. В основе этого метода лежит титрование воды в присутствии аммиачного буферного раствора (рН=10,0) и индикатора раствором комплексона III до перехода розовой окраски в голубую.
При анализе применяют один из индикаторов: кислотный хром синий К или эриохром черный Т. В присутствии ионов жесткости ![]() и
и ![]() эти индикаторы окрашиваются в розовый цвет, в отсутствии - в голубой. Комплексен III - двузамещенная натриевая соль этелендиаминтетра - уксусной кислоты:
эти индикаторы окрашиваются в розовый цвет, в отсутствии - в голубой. Комплексен III - двузамещенная натриевая соль этелендиаминтетра - уксусной кислоты:
При титровании жесткой воды раствором комплексна III образуется внутрикомплексное соединение:
т.е. связываются ионы ![]() и
и ![]() . Поэтому в конце титрования индикатор изменяет окраску, раствор становится голубым. Определение картой жесткости воды - Жк сводится к определению концентрами гидрокарбоната-иона НСО3 и, тем самым, эквивалентной этим ионам концентрации ионов жесткости
. Поэтому в конце титрования индикатор изменяет окраску, раствор становится голубым. Определение картой жесткости воды - Жк сводится к определению концентрами гидрокарбоната-иона НСО3 и, тем самым, эквивалентной этим ионам концентрации ионов жесткости ![]() и
и ![]() . Анализ проводят методом нейтрализации.
. Анализ проводят методом нейтрализации.
В основе этого метода лежит титрование воды в присутствии индикатора метилового оранжевого раствором соляной кислоты до перехода желтой окраски индикатора в оранжевую.
Метиловый оранжевый - кислотно-основной индикатор, изменяющий свою окраску от красной при рН<3,1 до желтой при рН>4,4.
В точке перехода 3,1 метиловый оранжевый имеет оранжевую окраску.
Анион ![]() - в воде гидролизуется:
- в воде гидролизуется:
![]()
Поэтому при условии Жк>0 вода имеет щелочную реакцию среды и метиловый оранжевый в ней окрашен в желтый цвет. При титровании раствором НСl такой воды протекает реакция нейтрализации:
Смотрите также
Химические свойства ароматических углеводородов. Полиядерные ароматические соединения
Реакции электрофильного замещения:
галогенирование, нитрование, сульфирование, алкилирование, ацилирование.
Механизм реакции электрофильного замещения. Понятие о p- и s-комплексах, их строен ...
Обсуждение результатов
Полученные ранее на кафедре ХТООС МИТХТ им. М.В.Ломоносова
данные [25, 26] показывают, что в системах KI - PdI2 –
фенилацетилен (ФА) и KI - PdI2 – метилацетилен (МА) наблюдаются
развитые релаксацио ...
Азотная кислота
...


