Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Сравнение кислотности и основности в разных растворителяхОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Сравнение кислотности и основности в разных растворителях Сравнение кислотности и основности в разных растворителяхСтраница 4
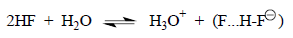
В данном случае образование HF2- , а не F- .HOH, обусловлено тем, что анион F- имеет заряд, сконцентрированный на очень небольшом атоме и тем, что молекула HF сильно полярна и является более сильной кислотой, чем вода.
Образование ионных пар. Если растворитель неспособен эффективно сольватировать анионы с помощью водородных связей, то анионы могут образовывать комплексы с присутствующими в растворе противоионами, т.е. с катионами. Такие комплексы называются ионными парами. В ионных парах катион и анион связаны главным образом силами электростатического притяжения (см. разд. 2.1.3, гл. 2), но если катионом является ион аммония (например, в ионной паре ацетата аммония CH3COO-NH4+), то помимо чисто электростатической связи образуются и водородные связи:
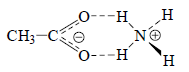
Ионные пары в заметном количестве образуются в средах с низкой диэлектрической проницаемостью, плохо сольватирующих ионы, например, в углеводородах, моноаминах, простых эфирах и т.д. Растворитель считается мало полярным, если его относительная диэлектрическая проницаемость меньше 10-12; таким образом, пользуясь табл. 3.5, можно представить, для какого растворителя характерно образование ионных пар. В диполярных апротонных растворителях (ацетонитриле, ДМСО, ДМФА, гексаметилфосфортриамиде, ацетоне и т.д.) ионные пары образуются хотя и в меньшей, но все же заметной степени. Дело в том, что хотя эти растворители имеют высокую относительную диэлектрическую проницаемость, их молекулы не содержат атомов водорода, способных образовывать достаточно сильные водородные связи. С другой стороны, хотя карбоновые кислоты обладают большой склонностью к образованию водородных связей с анионами, для них характерно образование ионных пар, так как эти растворители имеют низкую диэлектрическую проницаемость (кроме муравьиной кислоты НСООН). То же самое относится к спиртам (кроме метанола и этанола): например, трет-бутилат калия в трет-бутаноле является основанием более сильным, чем трет-бутилат натрия, так как меньший по размерам более жесткий катион Na+ лучше координируется с анионом (СН3)3СО- (жесткое основание).
Сольватация незаряженных частиц, участвующих в кислотно-основном равновесии. При переходе от воды к метанолу растворимость пара-нитробензойной кислоты возрастает в 125 раз, а пикриновой кислоты - лишь в 11 раз. Это значит, что при замене воды на метанол сольватация пара-нитробензойной кислоты увеличивается в 125/11=11,4 раза сильнее, чем сольватация пикриновой кислоты. В воде пикриновая кислота в 400 раз, а в метаноле в 19 500 раз сильнее пара-нитробензойной кислоты. Следовательно, 49-кратное изменение относительной кислотности, происходящее при переходе от воды к метанолу, состоит из 11,4-кратного эффекта, связанного с различием в сольватации нейтральных молекул этих кислот и только из 4,3-кратного эффекта, связанного с изменением сольватации сопряженных оснований. Этот пример показывает, что при анализе влияния растворителя на кислотно-основные свойства необходимо учитывать изменение в сольватации всех частиц, участвующих в равновесии, и не только ионов, но и нейтральных молекул. Хотя в большинстве случаев влияние растворителя в первую очередь связано с сольватацией ионов, имеющих сильно локализованный заряд, неэкранированный объемистыми неполярными группами, для полной картины необходимо учитывать и сольватацию электрически нейтральных компонентов кислотно-основного равновесия.
Сольватация, связанная с поляризуемостью. Взаимодействие между диполем и индуцируемым диполем или между двумя индуцированными диполями увеличивается с ростом поляризуемости взаимодействующих молекул и уменьшается с увеличением расстояния между ними (разд. 2.1.3). Молекулы или ионы, в которых электроны сильно делокализованы, обладают большей поляризуемостью. Таким образом, если в какой-то реакции образуются или исчезают частицы с сильно делокализованными электронами, можно ожидать, что на эту реакцию будет влиять изменение поляризуемости растворителя. Если растворитель состоит из небольших по размерам молекул, то у него сольватация, обусловленная поляризуемостью, будет мала. В частности, у воды эффективная поляризуемость значительно ниже, чем у большинства других растворителей. Это обусловлено не только тем, что атом кислорода, связанный простой связью с атомами водорода, менее поляризуем, чем атомы углерода и серы или атом кислорода, связанный двойной связью, но и тем, что молекула воды состоит всего из трех небольших атомов, которые могут тесно приблизиться к молекуле растворенного вещества. Когда молекула растворенного вещества окружается несколькими молекулами воды, каждый из трех атомов, образующих эти молекулы Н2О, будет расположен очень близко к некоторой области большой молекулы растворенного вещества. Молекулы воды во втором слое растворителя находятся дальше от молекулы растворенного веществ по сравнению с молекулами первого слоя на величину ван-дер-ваальсова расстояния между двумя молекулами воды (рис. 3.5,а). Однако когда молекула растворенного вещества окружена крупными молекулами растворителя, первый слой атомов вокруг молекулы растворенного вещества находится на таком же расстоянии, как и молекулы Н2О в случае водных растворов, но второй слой состоит главным образом из тех молекул растворителя, к которым принадлежат и атомы первого слоя (рис. 3.5,б). Следовательно, атомы второго слоя отстоят от молекулы растворенного вещества уже не на ван-дер-ваальсово расстояние, как было в случае сольватации водой, а лишь на длину ковалентной связи, которая значительно меньше суммы ван-дер-ваальсовых радиусов (см. табл. 2.2, гл. 2). Это значит, что второй слой атомов будет активнее участвовать в дисперсионных взаимодействиях с растворенным веществом.
Смотрите также
Дискриминация гипотез по кинетическим экспериментам
...
Химические элементы - токсиканты атмосферы и воды
Развитие промышленности неразрывно связано с
расширением круга используемых химических веществ. Увеличение объемов
применяемых
пестицидов, удобрений и других химикатов - характерная ...
Автоматизация процесса прокалки кокса
Прокаленный кокс используется для изготовления
электродов, применяемых в электролизерах для электролиза алюминия. Кокс
прокаливается с целью удаления влаги и летучих компонентов для улучшени ...


