Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Окислительно-восстановительные
реакции.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Окислительно-восстановительные
реакции. Окислительно-восстановительные
реакции.
Цель работы - ознакомление с окислительно-восстановительными свойствами металлов, неметаллов и их соединений, освоение методики составления уравнений окислительно-восстановительных процессов.
Реакции, протекания которых связано со смещением или полным переходом электронов от одних атомов к другим, называют окислительно-восстановительными.
Число электронов, смещенных от атома (иона) данного элемента или к атому (иону) данного элемента в соединении, называют степенью окисления. Степень окисления может быть положительной (электроны смещены от атома или иона) и отрицательной (электроны сменены к атому или иону).
Процесс отдачи
электронов, т.е. повышения степени окисления элемента, называют окислением, а
вещества, отдающие электроны - восстановителями. К типичным восстановителям
относятся простые вещества, атомы которых характеризуются невысокой
электроотрицательностью (металлы, водород, углерод), некоторые анионы (![]() ,
, ![]() ,
, ![]() и др.); катионы, у которых степень
окисления может возрастать (
и др.); катионы, у которых степень
окисления может возрастать (![]() ,
, ![]() и др.).
и др.).
Процесс
присоединения электронов, т.е. понижения степени окисления, называют
восстановлением, а вещества, принимающее электроны, называют окислителями. К
типичным окислителям относятся простые вещества, атомы которых характеризуются
высокой электроотрицательностью (элементы VI и VII групп главных
подгрупп), катионы с высокой степенью окисления (![]() ,
, ![]() ,
, ![]() ), анионы, в которых электроположительный
элемент имеет высокую степень окисления (
), анионы, в которых электроположительный
элемент имеет высокую степень окисления (![]() ,
, ![]() ,
, ![]() ), высшие оксиды, а также пероксиды.
), высшие оксиды, а также пероксиды.
Окислительно-восстановительные реакции - это одновременно протекающие процессы окисления и восстановления. Реакции, в которых окислители и восстановители представляют собой разные вещества, называют межмолекулярными. Если окислителями и восстановителями служат атомы или ионы одной и той же молекулы, то такие реакции называют внутримолекулярными.
Составление окислительно-восстановительных реакций требует строгого соблюдения правил, изложенных в данном разделе, что поможет написать любую окислительно-восстановительную реакцию. Для этого существуют два метода электронного баланса и ионно-электронной полуреакции. Первый может пригодиться только тогда, когда известны все продукты реакции и исходные вещества, при этом основное правило - установить степени окисления элементов, которые в результате реакции изменили свою степень окисления, а затем для этих элементов записать уравнение электронного баланса, расставить коэффициенты в уравнении реакции и по кислороду проверить правильность написания уравнения.
Пример:
![]()
1) Установим степени окисления у всех элементов:
![]()
видно, что степень окисления изменили два элемента - железо и марганец. Составим для них уравнение электронного баланса:
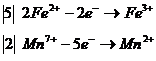
расставим коэффициенты около окислителя и восстановителя:
![]()
а теперь методом "пинг-понга" устанавливаются последовательно коэффициенты в левой и правой части у всех остальных элементов так, чтобы последним уравнивался водород.
![]()
Справа и слева имеется по 80 атомов кислорода, следовательно, коэффициенты в уравнении расставлены правильно.
Метод полуреакций, или ионно-электронный, применяется только в том случае, когда неизвестны все вещества, входящие в уравнение. Этот метод решения окислительно-восстановительных реакций намного мощнее метода электронного баланса, он позволяет написать продукты и расставить коэффициенты в реакции, если известны только исходные вещества и среда, в которой происходит реакция.
Последовательность действий при написании окислительно-восстановительных реакций ионно-электронным методом следующая:
1) необходимо установить, какое вещество восстановитель, а какое окислитель;
2) в соответствии с ниже приведенными схемами записываются полуреакции (в ионном виде) с окислителями и восстановителями. Заряд в этих реакциях уравнивается прибавлением или отниманием электронов в левой части уравнения, необходимо при этом учесть, что:
a) окислитель превращается в ион с низшей степенью окисления;
b) восстановитель превращается в соединение с высшей степенью окисления;
3) находится число, равное наименьшему общему кратному между числом электронов в полуреакциях окисления и восстановления;
4) полуреакции складываются;
5) записывается уравнение из противоионов для левой части и такое же уравнение для правой части;
6) записывается суммарное молекулярное уравнение реакции.
Схемы для ионно-электронного метода (полуреакций)
1) Если в исходных веществах больше кислорода, то в продуктах реакций на каждый атом кислорода имеем:
в кислой среде молекулу воды
![]()
в щелочной' и нейтральной среде – гидроксогруппу
![]()
2) Если в исходных веществах меньше кислорода, то в продуктах на каждый атом кислорода имеем:
в кислых и нейтральных средах
![]()
в щелочной среде
![]()
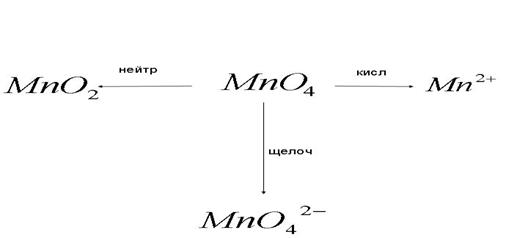
3) Превращение, аниона перманганата в окислительно-восстановительных процессах:
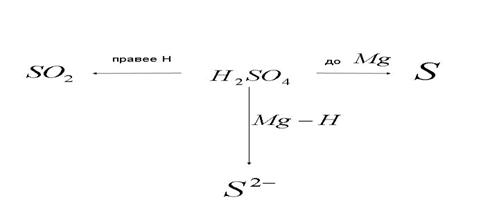
4) Взаимодействие концентрированной серной кислоты с металлами:
5) Превращения бихромат - иона в окислительно-восстановительных процессах:
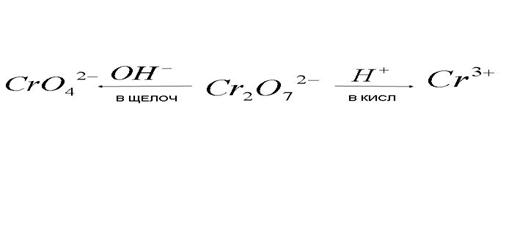
Из неметалла образуется кислота с высшей степенью окисления неметалла.
Разберем принцип написания окислительно-восстановительных реакций ионно-электронным методом на следующем примере:
![]()
Окислителем
может быть только бихромат калия, т.к. в этом соединении он имеет высшую
степень окисления +6. ![]() добавлена для создания кислой среды,
следовательно, восстановителем является ион тиоцианата, в котором каждый
элемент является восстановителем.
добавлена для создания кислой среды,
следовательно, восстановителем является ион тиоцианата, в котором каждый
элемент является восстановителем.
Запишем реакцию окисления восстановителя в ионном виде:
![]()
(углерод
превращается в ![]() ,
как этого требует правило превращения восстановителя в анион высшей степени
окисления элемента). В кислой среде недостаток кислорода в исходном веществе
требует добавления к левой части уравнения воды:
,
как этого требует правило превращения восстановителя в анион высшей степени
окисления элемента). В кислой среде недостаток кислорода в исходном веществе
требует добавления к левой части уравнения воды:
![]()
уравновесим
заряд (![]() добавили,
т.к. необходимо в левую часть прибавить 7 атомов кислорода)
добавили,
т.к. необходимо в левую часть прибавить 7 атомов кислорода)
![]()
Запишем процесс восстановления окислителя, воспользовавшись вышеприведенной схемой:
![]()
В исходном веществе больше кислорода, среда кислая, следовательно, к свой части необходимо добавить - протоны:
![]()
уравновесим заряд
![]()
и в результате получим
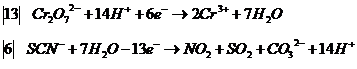
после сложения получим ионное уравнение:
![]()
после удаления молекул воды и протонов водорода получим:
![]()
Напишем уравнение из противоионов:
![]()
Суммарное уравнение в молекулярном виде
![]()
Обратите
внимание, что один из продуктов реакции (![]() ) может реагировать с серной кислотой,
которую обычно добавляют в избытке:
) может реагировать с серной кислотой,
которую обычно добавляют в избытке:
![]()
но, так как в реакции получилось 6-молекул карбоната калия, то последнее уравнение необходимо умножить на 6 и эти два уравнения сложить в результате получим:
![]()
Приведем одинаковые вещества под один коэффициент:
![]()
Экспериментальная часть.
Смотрите также
Железо в организме человека
...
Характеристика химического элемента № 6 Углерод
...
Характеристика элементов ниобия и тантала
По размеру, как атомов, так и
ионов ниобий и тантал близки друг к другу, поэтому их свойства как элементов
целесообразно рассмотреть одновременно. Одинаковые объемы атомов объясняются
тем, что член ...


