Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ЭнтропияСтраница 2
![]() .
.
Так как отношение (n1+n2)/n1 представляет собой величину, обратную молярной доле данного компонента
![]()
то в общем виде можно записать выражение энтропии моля газа в смеси следующим образом:
![]() (24)
(24)
![]() (25)
(25)
Полученное выражение определяет очень важное понятие, а именно—рассеяние вещества, так как если N → 0, то энтропия стремится к ∞.
В природе существуют так называемые рассеянные элементы, общее содержание которых, вообще говоря, не так мало, но они присутствуют в очень малых количествах в различных минералах, водах и т. д. Для того чтобы выделить эти элементы в свободном виде, их сначала надо концентрировать, а это трудно и требует очень большой затраты энергии. Так, например, морская вода содержит ничтожные количества золота, но так как воды в мировом океане очень много, то и золота в ней тоже огромное количество” Однако если золото выделять из морской воды известными методами, то оно будет “дороже золота”.
Приращение энтропии при смещении газов — RlnNi можно использовать при рассмотрении любых разбавленных растворов. В растворах более концентрированных взаимодействие между молекулами растворенного вещества уменьшает их активность, и поэтому в таких случаях вместо величин концентрации в уравнение под' ставляют величины “активности” а:
![]()
где а — активность; γ — коэффициент активности, стремящийся в разбавленных растворах к единице; Ni, — молярная доля. Энтропия реальных веществ, способных менять свое агрегатное или полиморфное состояние, определяется сложнее, так как для каждого состояния значение энтропии будет иное.
Изменение энтропии ΔS при любом превращении вещества можно определить по уравнению
![]() (26)
(26)
где ΔHпревращ— изменение энтальпии при превращении; Тпревращ — температура превращения.
Зависимость энтропии от температуры определяется из уравнения
![]() (27)
(27)
где Ср — теплоемкость при постоянном давлении ![]() . Общая формула температурной зависимости с учетом возможных агрегатных превращений будет
. Общая формула температурной зависимости с учетом возможных агрегатных превращений будет
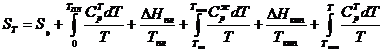 (28)
(28)
Для удобства расчетов и построения таблиц в справочниках приняты стандартные значения энтропии при Т =298,15 К и р = 1,013∙105Па, т.е. значения при тех же условиях, что и в случае расчета энтальпий. Некоторые значения стандартных энтропии приведены в табл.1 .
Таблица 1. Значения стандартных энтропий S0 для некоторых веществ.
|
Вещество |
S0 |
Вещество |
S0 |
Вещество |
S0 |
Вещество |
S0 |
|
H2O (г) |
188,74 |
H (г) |
114,6 |
Cl2 (г) |
223,0 |
CO2 (г) |
213,6 |
|
H2O (ж) |
69,96 |
H2 (г) |
130,6 |
HCl (г) |
186,7 |
FeO (кр) |
58,79 |
|
H2O (кр) |
39,33 |
O2 (г) |
205,03 |
CO (г) |
197,4 |
α – Fe (кр) |
25,15 |
Смотрите также
Гидролиз солей. Особенности почвенного гидролиза
...
Методы определения активности катализаторов
...
Термодинамика химической и электрохимической устойчивости сплавов системы Ni-Si
Сплавы кремния с никелем относятся к группе аморфных
металлических сплавов [1]. Следствием их аморфной структуры являются необычные магнитные,
механические, электрические свойства и высокая ...


