Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ЭнтропияСтраница 1
Наиболее информативной термодинамической функцией в уравнении (19) является энтропия S.
Значение энтропии легко определить только для состояния идеального газа. Используем для вычисления S уравнение (18), где dU — изменение внутренней энергии, равное для идеального газа СvdT т.е. теплоемкости при постоянном объеме, умноженной на приращение температуры: pdv — приращение работы, которое можно представить как![]() , заменив р на RT/v. Отсюда
Лучшие проститутки тулы ждут вашего звонка. | Шлюхи Наро-Фоминска гарантируют конфиденциальность и безопасность.
, заменив р на RT/v. Отсюда
Лучшие проститутки тулы ждут вашего звонка. | Шлюхи Наро-Фоминска гарантируют конфиденциальность и безопасность.
![]() (20)
(20)
После интегрирования в пределах 0¾T получаем
![]() (21)
(21)
|
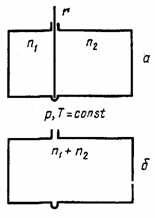
рис. 2 Схема для расчета энтропии при самопроизвольном смешивании двух газов. |
где ST — энтропия при температуре Т; S0 — энтропийная постоянная; Сv — теплоемкость при постоянном объеме; v — молярный объем. Таким образом, энтропия моля идеального газа является функцией Т и р (так как молярный объем зависит от Т и р). Выражение (21) применимо лишь для чистого идеального газа, так как для смесей газов, даже при отсутствии между ними химических реакций, энтропия смеси будет возрастать за счет необратимых процессов диффузии, приводящей к распределению компонентов по всему объему газовой смеси. Рассмотрим процесс самопроизвольного смешения двух газов. Пусть в двух частях объема, разделенного перегородкой r (рис. 2, а), находится n1 молей первого газа и n2 молей второго газа при р, Т=const. |
Общая энтропия системы
![]() (22)
(22)
где S1 и S2 — молярные энтропии первого и второго газов. Удалим перегородку r и дадим возможность газам образовать смесь, равномерно распределенную по всему объему ![]() (рис 2,б), где v —молярный объем газа при данных р и Т. На каждый моль компонентов смеси приходятся пропорциональные части объема:
(рис 2,б), где v —молярный объем газа при данных р и Т. На каждый моль компонентов смеси приходятся пропорциональные части объема:
![]() и
и ![]()
Подставляем значения этих объемов в уравнение (21) и получаем значения энтропии для одного моля компонента в смеси:
![]()
![]()
Общий запас энтропии в смеси газов тоже увеличился:
![]() (23)
(23)
Приращение энтропии в газовой смеси зависит от соотношения чисел молей компонентов n1 и n2. Если положить, что n1 → 0, то энтропия этого газа
![]()
но доля, вносимая этим компонентом в общий запас энтропии системы, также стремится к нулю: ![]() . В то же время если n1→ 0, то (n1+n2)/n2 стремится к 1, а
. В то же время если n1→ 0, то (n1+n2)/n2 стремится к 1, а ![]() тоже стремится к нулю. Следовательно, при исчезновении одного из компонентов газовой смеси энтропия другого компонента станет равна энтропии чистого газа:
тоже стремится к нулю. Следовательно, при исчезновении одного из компонентов газовой смеси энтропия другого компонента станет равна энтропии чистого газа:
Смотрите также
Исследование кинетики реакции
...
Методика обработки экспериментальных данных
Вся процедура обработки
экспериментальных данных может быть разделена на два этапа. На первом
производится первичная обработка сведений, полученных при проведении
эксперимента по химическом ...