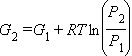Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Химическое равновесиеОткрытая химия / Химическая термодинамика / Открытая химия / Химическая термодинамика / Химическое равновесие Химическое равновесиеСтраница 1
Для определения величины ΔG в условиях, отличных от стандартных, используют уравнение зависимости изобарно-изотермического потенциала от концентрации и температуры.
Используя соотношения (4.1) и (4.2), получаем:
|
(4.3) |
Рассмотрим вместо небольших, но конечных изменений (ΔG, ΔH, ΔS) бесконечно малые изменения всех параметров, входящих в уравнение (4.3). Тогда оно приобретает вид:
|
dG = dU + P dV + V dP – T dS – S dT. |
(4.4) |
Подставив в него dU = δQ – δA, получим:
|
dG = δQ – δA + P dV + V dP – T dS – S dT. |
(4.5) |
Если реакция протекает при постоянной температуре (S dT = 0) и обратимо (ΔQ = T dS), а единственной совершаемой в ходе реакции работой является работа расширения (δА = P dV), то в правой части (4.5) все члены, кроме V dP, взаимно сокращаются или равны нулю. Тогда получаем:
|
dG = V dP. |
Для одного моля идеального газа V = RT / P и, следовательно,
|
dG = RT dP / P = RT d (lnP) |
Интегрируя, получаем
|
(4.6) |
Это уравнение позволяет, зная молярную энергию Гиббса идеального газа G1 при парциальном давлении P1, вычислить молярную энергию Гиббса G2 при парциальном давлении P2. Хотя уравнение 4.6 выведено для обратимой реакции, оно в равной мере применимо и к необратимым процессам, поскольку G является функцией состояния, и ее изменение не зависят от способа перехода из состояния 1 в состояние 2. Допустив, что состояние 1 является стандартным, а состояние 2 произвольным, уравнение (4.6) можно записать в виде:
|
(4.7) |
Смотрите также
Синтез 2,2-диэтоксииндандиона
Аминокислоты, пептиды
и протеины, или белки образуют группу химически и биологически родственных
соединений, которым принадлежит очень важная роль в жизненных процессах. При
полном гидролиз ...
Электрофильное ароматическое замещение
Электрофильное замещение, несомненно, составляет самую
важную группу реакций ароматических соединений. Вряд ли найдется какой-нибудь
другой класс реакций, который так детально, глубоко и все ...
Нестандартные вопросы химии и их решения
1. «Поющая
колба». Выделение энергии в ходе химических реакций происходит обычно в
виде теплоты, света или других электромагнитных излучений. Обсудите возможность
выделения энергии химическ ...