Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Химическое равновесиеОткрытая химия / Химическая термодинамика / Открытая химия / Химическая термодинамика / Химическое равновесие Химическое равновесиеСтраница 3
При определенных условиях активности реагентов могут быть заменены концентрациями или парциальными давлениями. В этих случаях константа равновесия, выраженная через равновесные концентрации Kc или через парциальные давления Kp, принимает вид
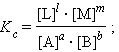 |
(4.11) |
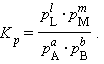 |
(4.12) |
Уравнения (4.11) и (4.12) представляют собой варианты закона действующих масс (ЗДМ) для обратимых реакций в состоянии равновесия. При постоянной температуре отношение равновесных концентраций (парциальных давлений) конечных продуктов к равновесным концентрациям (парциальным давлениям) исходных реагентов, возведенных соответственно в степени, равные их стехиометрическим коэффициентам, величина постоянная (К. Гульдберг, П. Вааге, 1867 г.).
Для газообразных веществ Kp и Kc связаны соотношением Kp = (RT)ΔnKc, где Δn – разность числа молей начальных и конечных газообразных реагентов.
Константа равновесия определяется при известных равновесных концентрациях реагирующих веществ или по известной ΔG° химической реакции.
Смотрите также
Новые научные направления современной химии и их прикладное использование
Химия
- наука социальная. Её высшая цель – удовлетворять нужды каждого человека и
всего общества. Многие надежды человечества обращены к химии. Молекулярная
биология, генная инженерия и би ...
Изучение и анализ производства медного купороса
Целью
данного дипломного проекта является изучение и анализ производства медного
купороса, основанного на переработке отработанного передаточного электролита
цеха электролиза меди.
В
хо ...
Композиционные материалы на основе полибутилентерефталата и его сополимеров
...


