Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Химическое равновесиеОткрытая химия / Химическая термодинамика / Открытая химия / Химическая термодинамика / Химическое равновесие Химическое равновесиеСтраница 3
При определенных условиях активности реагентов могут быть заменены концентрациями или парциальными давлениями. В этих случаях константа равновесия, выраженная через равновесные концентрации Kc или через парциальные давления Kp, принимает вид
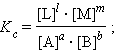 |
(4.11) |
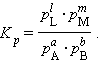 |
(4.12) |
Уравнения (4.11) и (4.12) представляют собой варианты закона действующих масс (ЗДМ) для обратимых реакций в состоянии равновесия. При постоянной температуре отношение равновесных концентраций (парциальных давлений) конечных продуктов к равновесным концентрациям (парциальным давлениям) исходных реагентов, возведенных соответственно в степени, равные их стехиометрическим коэффициентам, величина постоянная (К. Гульдберг, П. Вааге, 1867 г.).
Для газообразных веществ Kp и Kc связаны соотношением Kp = (RT)ΔnKc, где Δn – разность числа молей начальных и конечных газообразных реагентов.
Константа равновесия определяется при известных равновесных концентрациях реагирующих веществ или по известной ΔG° химической реакции.
Смотрите также
Ниобий
Ниобий — это химический
элемент XX в. в прямом и переносном смысле. Хотя как элемент его
открыли в самом начале XIX в. (1801 г.), но как металл был получен лишь
век спустя (1907 г.), а сейчас без н ...
Водородные связи
Интерес к олигомерам фторида водорода (димеру,
тримеру) в последние десятилетия поистине велик. Объясняется это прежде всего
той ролью, которую играет водородная связь при интерпретации, мод ...
Химический элемент калий
Человечество
знакомо с калием больше полутора веков. В лекции, прочитанной в Лондоне 20
ноября 1807 г., Хэмфри Дэви сообщил, что при электролизе едкого кали он
получил «маленькие шарик ...


