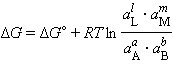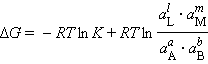Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Химическое равновесиеОткрытая химия / Химическая термодинамика / Открытая химия / Химическая термодинамика / Химическое равновесие Химическое равновесиеСтраница 2
где – стандартный изобарно-изотермический потенциал вещества j;
![]() – его активная концентрация (активность).
– его активная концентрация (активность).
Для идеальных растворов активная концентрация определяется как отношение концентрации этого вещества при заданных условиях к его концентрации в стандартном состоянии a = C/C°. Вещества в стандартном состоянии имеют a = 1.
В соответствии с (4.7) энергия Гиббса произвольной химической реакции
|
aА + bВ = lL + mМ |
равна:
|
(4.8) |
При достижении равновесия (ΔG = 0) уравнение (4.8) принимает вид
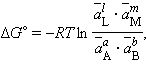 |
где
– равновесные значения активных концентраций.
Выражение под знаком логарифма, представляющее собой отношение произведения равновесных активностей продуктов к произведению активностей исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия:
| |
(4.9) |
|
|
|
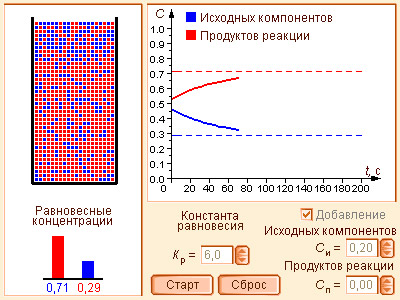
Модель 4.12. Химическое равновесие |
Подставив (4.9) в (4.8), получим уравнение, носящее название изотермы Вант-Гоффа:
|
(4.10) |
Смотрите также
Реакции С и О ацилирования
Реакции ацилирования обладают очень многими полезными свойствами. Они
позволяют вести в молекулу функциональную группу C=O путем реакций присоединения либо замещения, не подвергая исходную
м ...
Синтез и свойства комплексов железа (II) и железа (III)
Цель данной работы состоит в изучении строения и свойств комплексных
соединений железа (II) и железа (III).
В ходе выполнения работы были поставлены следующие задачи:
1) изучение литер ...
Анализ лекарственной формы состава: Rp.: Amidopyrini 0,3 Dibazoli 0,02
Амидопирин – белые кристаллы или белый кристаллический порошок без запаха,
слабогорького вкуса. Температура плавления 110 – 113 °С. Медленно растворяется в
воде, легко – в спирте и в хло ...