Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Ионы и ионные пары щелочных солей карбанионовОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Ионы и ионные пары щелочных солей карбанионов Ионы и ионные пары щелочных солей карбанионовСтраница 3
Таблица 3.18
Зависимость λmax поглощения от кристаллографического радиуса катиона для щелочных солей флуорена в ТГФ при 25оС
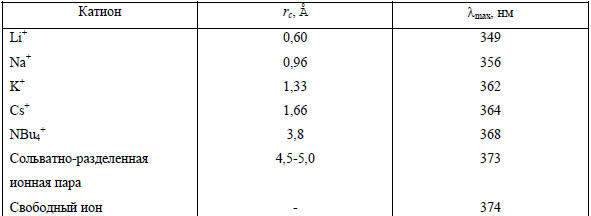
Характерно, что полосы поглощения для сольватно-разделенной ионной пары и свободного иона очень близки и для многих других солей карбанионов практически совпадают, что и следовало ожидать, исходя из большого радиуса сольватированного «изнутри» катиона в сольватно-разделенной ионной паре. Эти спектроскопические данные в совокупности доказывают возможность одновременного существования в растворе двух форм ионных пар. В более основных эфирных растворителях, таких как диметоксиэтан (ДМЭ), диглим, тетраглим, доля сольватно-разделенных ионных пар для Li-, Na- и К-соли флуорена резко возрастает, а в ДМСО происходит уже диссоциация ионных пар. Это означает, что не полярность растворителя, а его основность является определяющим фактором для перехода контактной ионной пары в сольватно-разделенную. Объяснение заключается в более сильной сольватации щелочного катиона глимами, т.е. основность среды играет решающую роль в процессе ионизации металлических производных углеводородов RM.
Подобные закономерности на протяжении последних двадцати лет неоднократно наблюдались при анализе спектров поглощения в УФ и видимой области для щелочных солей других карбанионов - трифенилметил-анионов Ar3C-M+, бензгидрил-анионов Ar2CH-M+, бензил-анионов ArCH2-M+, пропаргил-анионов RC≡C-CH-R-M+, аллил-анионов и т.д. Для этих анионов было установлено, что контактные и сольватно-разделенные ионные пары сосуществуют в ТГФ, ДМЭ и полиглимах, и положение равновесия между ними зависит от природы карбаниона, катиона щелочного металла и сольватирующей способности растворителя. В отличие от щелочных солей карбанионов алкоголяты, феноляты и еноляты щелочных металлов, по-видимому, существуют в виде контактных ионных пар в недиссоциирующих средах. Это утверждение основывается на том, что величины максимумов поглощения для этих солей в УФ-спектре, как правило, линейно коррелируют с величиной 1/rс, где rс - кристаллографический радиус катиона. Такая зависимость рассматривается как характерный и верный признак наличия именно контактной формы ионной пары. В диполярных апротонных и полярных протонных растворителях щелочные алкоголяты, феноляты и еноляты частично диссоциируют прямо из контактной ионной пары с образованием «свободных» анионов. Для них наблюдается превосходная корреляция между λmax поглощения и обратной величиной кристаллографического радиуса 1/rс - зависимость, типичная для контактных ионных пар.
Эти соли в малоосновной и малополярной среде сильно ассоциированы в димеры, тримеры и более высокие агрегаты контактных ионных пар (гл. 17). В диполярных апротонных растворителях эти агломераты контактных ионных пар разрушаются на мономеры, которые частично диссоциируют в ДМСО, ГМФТА, N-метилпирролидоне, ДМФА, но не в ацетонитриле, бензонитриле, не обладающих высокой ионизирующей способностью.
Дальнейшее усложнение проблемы ассоциации ионов заключается в том, что в некоторых случаях возможно образование двух форм контактных ионных пар. Продолжая изучение контактных и сольватно-разделенных ионных пар, Смид изучал влияние очень небольших добавок комплексообразующих агентов на спектр поглощения щелочных солей флуорена в диоксане, где соли флуорена находятся только в воде контактных ионных пар. При введении соизмеримых с концентрацией солей флуорена количеств полиглимов, или, что еще лучше, краун-полиэфиров, наблюдался переход обычных контактных ионных пар в так называемые «внешние комплексные контактные ионные пары» F-M+S (где S - молекулы глима или крааун-полиэфир). Предполагается, что катион в этой форме ионных пар сольватирован только по периферии иона, и в межионном пространстве нет молекул растворителя. Это приводит к батохромному сдвигу максимума поглощения который, однако, не достигает величины, характерной для сольватно-разделенной ионной пары. Подобная же картина наблюдалась для щелочных солей 1,2-дифенилбутена-1 и 1,3-дифенилпропена-1, для которых экспериментальные данные были интерпретированы таким образом, что в эфирных растворах устанавливается равновесие между тремя формами ионных пар - двумя контактными и одной сольватно-разделенной.
Смотрите также
Полимерные сорбенты для распределительной хроматографии
Ограниченный
рабочий диапазон рН и сорбционная активность остаточных силанольных групп
сорбентов на основе силикагеля стимулировали разработку полимерных сорбентов
для распределительной хро ...
Применение ЭВМ в технологии лекарственных препаратов
...
Получение аллилового спирта гидролизом хлористого аллила
Непредельные спирты - это производные непредельных
углеводородов, в молекулах которых водородный атом замещен на гидроксильную
группу. Непредельные спирты сильно отличаются по свойствам от у ...


