Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Ионы и ионные пары щелочных солей карбанионовОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Ионы и ионные пары щелочных солей карбанионов Ионы и ионные пары щелочных солей карбанионовСтраница 1
Термин «ионная пара» обозначает ионный ассоциат из двух противоположно заряженных ионов, которые находятся в электростатической контакте, но обладают, по существу, той же структурой, что и свободные разделенные ионы. Понятие о ионных парах было введено в 1926 г. Н.Бьеррумом для ионофоров - солей щелочных - щелочно-земельных металлов, которые имеют ионное строение в отличие от ионогенов, состоящих из нейтральных ковалентных полярных молекул. В растворах ионофоров противоположно заряженные ионы находятся либо в контакте, либо на таком расстоянии, что кулоновское взаимодействие не играет заметной роли.
Первоначально полагали, что ионофоры в растворе нацело диссоциированы, и коэффициент активности иона в растворе описывается известным уравнением Дебая-Хюккеля. Оказалось, однако, что эта теория совершенно не пригодна для описания не только концентрированных растворов, но, что особенно важно, не соглавуется с экспериментальными данными для растворов с низким ε<15 и средним значением ε<20—40 диэлектрической проницаемости, т.е. при сильных межионных взаимодействиях. В этом случае нельзя пренебрегать ассоциацией ионов, так что помимо свободных ионов в растворе находятся ионные пары, обарзующиеся при спаривании двух противоположно заряженных ионов. Поскольку энергия электростатического взаимодействия двух разноименно заряженных ионов определяется согласно закону Кулона выражением
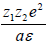
, где а - расстояние между ионами, концепция ионных пар применима в том случае, когда этот член больше 2kВТ, где kВ - постоянная Больцмана. При условии, когда энергия электростатического притяжения двух ионов значительно превышает их тепловую энергию, в растворе образуется новая частица, обладающая достаточной стабильностью для того, чтобы не разрушаться в продолжение большого числа соударений с молекулами растворителя. Ионные пары в растворе симметричных электролитов не несут электрического заряда, но имеют значительный дипольный момент. Поэтому они не дают никакого вклада в электропроводность, а с термодинамической точки зрения весь эффект сводится к удалению из раствора некоторого числа ионов и введению вместо них дипольных молекул в количестве, равном числу ионных пар. Немедленно возникает вопрос: когда два соседних иона могут быть названы ионной парой?
Согласно теории Бьеррума, любой ион, оказавшийся на расстоянии r<rc от противоиона, образует с ним ионную пару, а ион, оказавшийся вне сферы с r=rc является свободным. В качестве такого критического расстояния rc была предложена величина
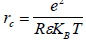 . Нетрудно заметить, что на расстоянии rc электростатическая потенциальная энергия двух ионов равна 2КВТ.
. Нетрудно заметить, что на расстоянии rc электростатическая потенциальная энергия двух ионов равна 2КВТ.
Дальнейшее развитие теории ассоциации ионов заключается в том, что ионные пары в растворе существуют в форме по крайней мере двух (а возможно, и более) дискретных форм. Наличие у ионных пар дипольного момента приводит к сильному электростатическому взаимодействию с молекулами полярного растворителя. Следует различать два типа взаимодействия компонентов внутри ионной пары: 1) взаимодействия, в которых молекулы растворителя остаются вне ионной пары и 2) взаимодействия, при которых одна или несколько молекул растворителя внедрены между ионами в ионной паре. В самом начале разделения компонентов ионной пары молекулы растворителя не препятствуют их взаимному притяжению, так как расстояние между ионами еще слишком мало для размещения молекулы растворителя. Однако при некотором критическом расстоянии полярные молекулы растворителя размещаются между ионами, и потенциальная энергия системы понижается. Дальнейшее удаление ионов друг от друга в ионной паре вновь увеличивает энергию, которая постепенно приближается к постоянной величине, характерной для бесконечно удаленных ионов. Подобный характер изменения потенциальной энергии позволяет предположить существование двух типов ионных пар, названных контактными и сольватно-разделенными. Контактную ионную пару называют также тесной, внутренней или интимной, а сольватно-разделенную - внешней, или рыхлой. Однако термины «контактная» и «сольватно-разделенная» точнее всего передают физический смысл концепции ионных пар.
Смотрите также
Неорганические аниообменники, синтезированные на основе гидроксидов металлов
В представленных
статьях гидроксиды металлов рассмотрены в качестве ионитов в различных водных и
смешанных средах. Обсуждены химические и физические свойства, методы синтеза и
сорбционная а ...
Поверхностное натяжение и адсорбция на границе вода-воздух
...
Изучение химического состава снега
В эпоху
научно-технической революции антропогенные воздействия на окружающую среду
становятся интенсивными и масштабными. Серьезную опасность представляет
усиливающиеся загрязнение природны ...


