Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Взаимодействие серной кислоты с металлами.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Свойства элементов VA и VIA. / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Свойства элементов VA и VIA. / Взаимодействие серной кислоты с металлами. Взаимодействие серной кислоты с металлами.
Концентрированная серная кислота при нагревании окисляет почти все металлы, причем окислителем является молекула H2SO4. В зависимости от активности металла и температуры среды они восстанавливаются до SO2, S или H2S:
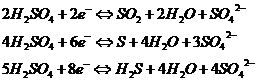
а) В пробирку поместите несколько кусочков медной стружки и налейте 1мл концентрированной серной кислоты (осторожно III). Захватив пробирку держателем, нагрейте ее нижнюю часть. Когда начнется выделение газа, осторожно определите по запаху, что за газ выделяется. Составьте уравнение реакции.
б) В пробирку поместите несколько кусочков цинка и налейте 1мл концентрированной серной кислоты (осторожно III). Захватив держателем пробирку, слегка подогрейте ее нижнюю часть и как только начнется выделение газа, определите его по запаху. Затем нагрейте пробирку и наблюдайте появление желтого осадка вследствие выделения серы. К отверстию пробирки поднесите фильтровальную бумажку, смоченную раствором соли свинца. О чем свидетельствует почернение бумажки? Составьте уравнение реакции.
Смотрите также
Нефть: происхождение, состав, методы и способы переработки
...
Фотохимические процессы в верхних слоях атмосферы
Атмосфера
начала образовываться вместе с формированием Земли. Некоторые геологические
процессы, например, излияния лавы при извержениях вулканов сопровождались
выбросом газов из недр Земли. ...
Новые материалы на основе полимерных нанокомпозитов
Сейчас с уверенностью можно
утверждать, что одним из наиболее перспективных, а также многообещающих
направлений развития современной науки является нанотехнология. Исходя из самого
названия ...


