Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Образование общей электронной пары.Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Образование общей электронной пары. Образование общей электронной пары.Страница 5
Cl* 3d Cl** 3d
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 3p 3p
3p 3p
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 3s 3s
3s 3s
![]()
![]()
![]()
![]()
![]() Cl*** 3d
Cl*** 3d
![]()
![]()
![]() 3p
3p
![]()
![]()
![]()
![]()
![]()
![]() 3s
3s
Поэтому атом хлора, в отличие от атома фтора, может принимать участие в образовании не только одной, но также трёх, пяти или семи ковалентных связей. Так, в молекуле хлорноватистой кислоты HClO атом хлора образует одну ковалентную связь, в хлористой кислоте HClO2 ¾ три, в хлорноватой кислоте HClO3 ¾ пять, а в молекуле хлорной кислоты HClO4 ¾ семь ковалентных связей.
Прочность ковалентной связи зависит от степени перекрывания электронных облаков неспаренных электронов двух атомов. Перекрывание электронных облаков может происходить в большей или меньшей мере в зависимости от типа орбиталей, участвующих в образовании химической связи.
Если перекрывание двух s-орбиталей принять за единицу, то перекрывание s- и p-орбиталей составит уже 1,7, а двух p-орбиталей ¾ 3. На рис. 4 схематически показано перекрывание орбиталей различного типа.
Область перекрывания электронных облаков находится в поле обоих ядер и характеризуется наиболее высокой электронной плотностью. Чем
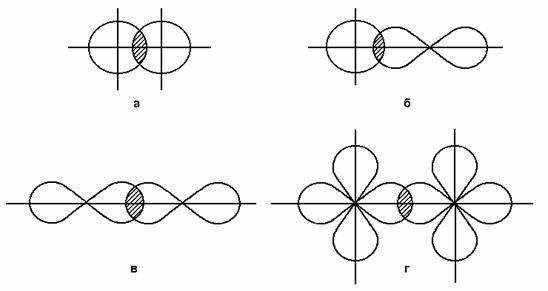 Рис. 4. Схематическое изображение перекрывания s- (а), p- (б), s- и p- (в) и d-орбиталей (г).
Рис. 4. Схематическое изображение перекрывания s- (а), p- (б), s- и p- (в) и d-орбиталей (г).
больше перекрываются облака электронов, образующих общую пару, тем прочнее связаны между собой атомы, тем выше энергия связи.
Смотрите также
Химико-токсикологический анализ лекарственных средств, производных фенотиазина
В России и за рубежом, начиная с 1945 г., после обнаружения фармакологической активности N-замещенных производных фенотиазина, было синтезировано большое число
препаратов, обладающих нейролеп ...
Методика обработки экспериментальных данных
Вся процедура обработки
экспериментальных данных может быть разделена на два этапа. На первом
производится первичная обработка сведений, полученных при проведении
эксперимента по химическом ...
Роль Менеделеева в развитии мировой науки
Менделеев Дмитрий
Иванович (годы жизни 1834 – 1907) - русский химик, разносторонний ученый,
педагог, прогрессивный общественный деятель. Открыл в 1869 году периодический
закон химических эл ...


