Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Образование общей электронной пары.Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Образование общей электронной пары. Образование общей электронной пары.Страница 1
Согласно современной теории химической связи, основанной на квантовомеханических представлениях, одним из возможных путей химического взаимодействия двух атомов является образование общей электронной пары за счет имеющих антипараллельные спины неспаренных электронов этих атомов. Атомы с неспаренными электронами, имеющими параллельные спины, отталкиваются, и химическая связь между ними не возникает. Устойчивая молекула образуется лишь в том случае, если её потенциальная энергия меньше суммарной потенциальной энергии образующих её атомов. Чем больше различаются эти энергии, тем прочнее молекула.
|
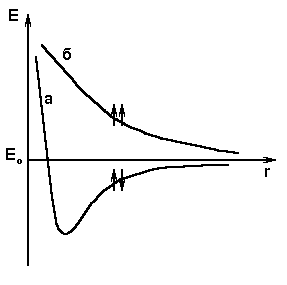
Рис. 3. Энергия системы, состоящей из двух атомов водорода с антипараллельными (а) и параллельными (б) спинами. |
При сближении двух атомов, имеющих во внешних электронных оболочках неспаренные электроны с антипараллельными спинами, между ними начинает действовать взаимное притяжение. В результате эти атомы сближаются еще больше, происходит замыкание полей и образование электронных пар. Однако расчет показал, что само по себе замыкание магнитных полей электронов со спинами противоположных направлений дает лишь очень небольшую часть той общей энергии, которая выделяется при образовании прочной валентной связи между атомами. Наличие неспаренных электронов следует рассматривать лишь как необходимое условие образования химической связи, являющейся результатом глубокого взаимодействия электронной пары с ядрами обоих атомов. где основное значение имеют электрические силы.
Квантовомеханический расчет показывает, что пребывание электронной пары в ионе двух ядер энергетически выгоднее, чем нахождение каждого неспаренного электрона в поле своего ядра. Энергия взаимодействия электронной пары с ядрами обоих атомов зависит от расстояния между реагирующими атомами. Так, на больших расстояниях эта энергия практически равна нулю. По мере сближения атомов увеличивается их взаимное притяжение, обусловленное электростатическим притяжением электронной пары обоими ядрами. Дальнейшее сближение атомов приводит к резкому преобладанию сил отталкивания. Поэтому химическая связь между двумя атомами характеризуется строго определенным расстоянием между ядрами, при котором притяжение между атомами максимально. Это расстояние называется длиной связи.
Квантовомеханические расчеты молекулы водорода показали, что при сближении двух атомов водорода с антипараллельными спинами энергия системы в целом уменьшается, проходит через минимум и при дальнейшем сближении атомов резко возрастает вследствие взаимного отталкивания положительно заряженных ядер (рис. 3, а). Минимальное значение энергии системы оказывается значительно ниже суммы энергий двух атомов водорода. Это означает. что при определенном сближении двух атомов водорода с антипараллельными спинами возможно образование прочной молекулы водорода H2. Напротив, сближение двух атомов водорода с параллельными спинами сопровождается непрерывным возрастанием энергии системы (кривая б на рис. 3). Следовательно, образование молекулы водорода в этом случае невозможно.
Образование химической связи между двумя атомами рассматривается как результат перекрывания их электронных облаков при сближении взаимодействующих атомов. Вследствие такого перекрывания облаков плотность отрицательного электрического заряда в пространстве между двумя ядрами атомов возрастает. Положительно заряженные ядра притягиваются к области перекрывания электронных облаков, в результате чего и образуется молекула. Эти представления о механизме взаимодействия двух атомов легли в основу теории химической связи, именуемой методом валентных связей.
Из сказанного следует, что валентность элемента определяется числом неспаренных электронов, принимающих участие в образовании химической связи. Валентные электроны элементов главных подгрупп расположены на s- и p-орбиталях внешнего электронного слоя; у элементов побочных подгрупп, за исключением лантаноидов и актиноидов, валентные электроны расположены на d-орбитали последнего (внешнего) слоя и s-орбитали предпоследнего электронного слоя.
Для правильной оценки валентности того или иного элемента необходимо иметь чёткое представление о распределении электронов по энергетическим уровням и подуровням и количестве неспаренных электронов. Руководствуясь принципом Паули и правилом Гунда, для атома каждого элемента в стационарном (невозбуждённом) состоянии можно определить число неспаренных электронов. Например, в основном состоянии внешний электронный слой атома углерода имеет структуру
Смотрите также
Реакторный графит: разработка, производство и свойства
Конструкционные
углеродные материалы (КУМ) нашли широкое применение в атомных реакторах
различного назначения: исследовательских, транспортных, промышленных
уран-графитовых (ПУГР), высокоте ...
Физико-химические свойства серебра
Серебро – известно человечеству с
древнейших времен. В природе оно встречается как в самородном состояние, так и
в виде соединений. Самой распространенной серебряной рудой является серебря ...
Исследование возможностей синтеза фенилселиконатов натрия, содержащих в своем составе атом кобальта
Министерство образования и науки Российской
Федерации
Федеральное государственное автономное образовательное
учреждение
Дальневосточный Федеральный Университет
Институт химии и прик ...