Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Физико-химические основы коагулирования примесей водыДипломы, курсовые и прочее / Дипломы, курсовые и прочее / Физико-химические основы коагулирования примесей воды Физико-химические основы коагулирования примесей водыСтраница 1
Седиментация под действием сил тяжести
Одним из наиболее широко применяемых на практике приемов снижения содержания взвеси в воде является седиментация под действием сил тяжести. Однако, примеси, обусловливающие мутность и цветность природных вод, отличаются малыми размерами, вследствие чего их осаждение происходит крайне медленно, так как силы диффузии превалируют над силами тяжести. Кроме того, наличие примесей коллоидного характера еще более осложняет процесс седиментации. Для ускорения процессов осаждения, фильтрования, флотации и повышения их эффективности прибегают к коагулированию примесей воды.
Коагуляцией примесей воды называется процесс укрупнения коллоидных и взвешенных частичек дисперсной системы, происходящей в результате их взаимодействия и объединения в агрегаты. Завершается этот процесс отделением агрегатов слипшихся частичек от жидкой фазы.
Диспергированные, коллоидные и взвешенные частички примесей природных вод в большинстве случаев имеют одинаковые заряды, что обусловливает возникновение межмолекулярных сил отталкивания и агрегативную устойчивость. Поскольку в технологии очистки воды предусматривается частичное или полное удаление примесей, агрегативную устойчивость частичек стремятся нарушить, а заряд их устранить или снизить до очень малых значений. Этого достигают добавлением к воде сульфатов алюминия, железа (II) и железа(III), хлорида алюминия, хлорида железа(III), алюмината натрия, оксихлорида алюминия и других веществ, которые, являясь коагулянтами, либо нарушают агрегативную устойчивость системы, либо образуют вследствие гидролиза коллоиды, сорбирующие примеси из воды.
Коллоидные примеси, находящиеся в природной воде, позволяют рассматривать ее как гетерофазную систему, в которой вода является дисперсионной средой, а масса распределенных в воде коллоидных частичек — дисперсной фазой. Эти частички представляют собой очень мелкие агрегаты кристаллического или аморфного строения. Благодаря огромной удельной поверхности коллоидных частичек они обладают весьма значительной поверхностной энергией, а следовательно, и высокой адсорбционной емкостью. Это обстоятельство имеет большое значение, поскольку основной процесс обработки воды — коагулирование — связан с адсорбцией на коллоидных частичках примесей, содержащихся в воде.
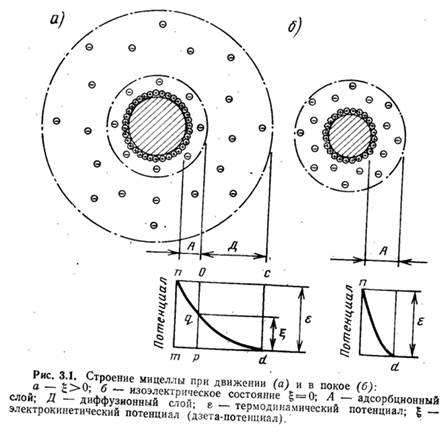
Возникновению коллоидных частичек предшествует образование твердой фазы (ядра), адсорбирующей из растворов потенциалобразующие ионы. Сильнее адсорбируются ионы, которые больше понижают свободную энергию поверхности твердой фазы. В результате поглощения ионов поверхность ядра приобретает заряд. Находящиеся в растворе разноименно заряженные ионы (противоионы) собираются у поверхности ядра вследствие электрического притяжения между разноименными электрическими зарядами, образуя коллоидную частичку. Если бы в растворе не было теплового движения, приводящего к перемещению ионов, противоионы образовали бы мономолекулярный слой (рис. 3.1,б), охватывающий коллоидную частичку на расстоянии ионного радиуса. Термодинамический потенциал у такого двойного слоя является потенциалом между твердой фазой и жидкостью. В действительности упорядоченное строение оболочки нарушается в результате теплового движения ионов в растворе, а слой окружающих частичку противоионов приобретает диффузный характер (см. рис. 3.1, а).
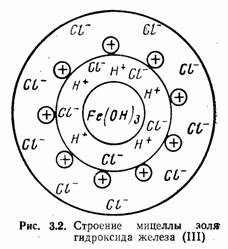
Коллоидная частичка вместе с окружающим ее диффузным слоем называется мицеллой. На рис. 3.2 представлена схема строения мицеллы золя Fe(OH)3, полученного вследствие гидролиза FeCl3. Золь — система, состоящая из коллоидных частичек, распределенных в жидкой среде. Если такой средой является вода, система называется гидрозолем. Как видно из рис. 3.2, мицелла Fe(OH)3 состоит из ядра, образованного молекулами Fe(OH)3, адсорбционносвязанных с ним потенциалобразующих водородных ионов (Н+) и некоторого количества ионов хлора С1 меньшего, чем количество ионов Н+, в результате чего коллоидная частичка имеет положительный заряд. Ионы Н+ и входящие в состав частички противоионы С1- образуют двойной электрический слой. Отдельные ионы хлора (С1-) образуют диффузный слой и вместе с коллоидной частичкой составляют мицеллу золя Fe(OH)3
Смотрите также
Характеристика элементов ниобия и тантала
По размеру, как атомов, так и
ионов ниобий и тантал близки друг к другу, поэтому их свойства как элементов
целесообразно рассмотреть одновременно. Одинаковые объемы атомов объясняются
тем, что член ...
Определение константы скорости реакции k по первым 3-м опытам
Из вида кинетического уравнения следует, что его единственным параметром
является константа скорости реакции k. Для
определения значения константы скорости воспользуемся статистическим методом
регр ...


