Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Расчет и построение диаграммы состояния Mn-Si-O при 250С. Анализ химической
устойчивостиДипломы, курсовые и прочее / Термодинамика химической устойчивости сплавов системы Mn-Si / Дипломы, курсовые и прочее / Термодинамика химической устойчивости сплавов системы Mn-Si / Расчет и построение диаграммы состояния Mn-Si-O при 250С. Анализ химической
устойчивости Расчет и построение диаграммы состояния Mn-Si-O при 250С. Анализ химической
устойчивостиСтраница 4
Задача состоит в том, чтобы подобрать последовательность равновесий, которая бы удовлетворяла условию возрастания давления кислорода в системе. При этом возможно проводить варьирование значений энергий Гиббса образования силицидов в пределах возможных справочных значений.
После многократного согласования энергий Гиббса образования силицидов, взятых из различных источников, получен следующий вариант последовательности окисления.
1. Si – Mn11Si19 – SiO2; (I)
2. Mn11Si19 – MnSi – SiO2; (II)
3. MnSi– Mn5Si3– SiO2; (III)
4. Mn5Si3 – MnSiO3– SiO2; (IV)
5. Mn5Si3 – MnSiO3 – Mn2SiO4; (V)
6. Mn5Si3 – Mn5Si2 – Mn2SiO4; (VI)
7. Mn5Si2– Mn3Si – Mn2SiO4; (VII)
8. Mn3Si –Mn2SiO4 – MnO; (VIII)
9. Mn9Si2 – Mn3Si – MnO; (IX)
10. Mn0,85Si0,15 – Mn9Si2 – MnO; (X)
11. α – Mn0,85Si0,15– MnO; (XI)
12. MnO – Mn3O4 – Mn2SiO4; (XII)
13. Mn3O4 – Mn2SiO4 – MnSiO3; (XIII)
14. Mn3O4 – Mn2O3 – MnSiO3; (XIV)
15. Mn2O3 – MnO2 – MnSiO3; (XV)
16. MnO2 – MnSiO3 – SiO2; (XVI)
17. MnO2 – Mn2O7 – SiO2; (XVII)
18. Mn2O7–SiO2–{O2}; (XVIII)
Примеры расчета:
а) Фазовое равновесие III: MnSi– Mn5Si3 – SiO2
Уравнение реакции, соответствующее данному равновесию:
![]() (1)
(1)
Константа равновесия реакции (1):
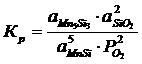 ; (2.1)
; (2.1)
Мольные доли компонентов равны единице, поэтому выражение для константы равновесия упрощается:
![]()
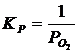 ; (2.2)
; (2.2)
Уравнение изотермы химической реакции:
![]() ; (2.3)
; (2.3)
Энергия Гиббса реакции (1) рассчитывается по формуле:
![]() ; (2.4)
; (2.4)
С учетом уравнения (2.2):
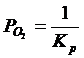
б) Фазовое равновесие X:
Mn0,85Si0,15 – Mn9Si2 – MnO
Уравнение реакции, соответствующее данному равновесию:
80Mn0,85Si0,15 + 7O2 = 6Mn9Si2 + 4MnO
Константа равновесия реакции (2):
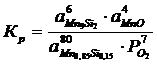 ;
;
Мольные доли компонентов равны единице, поэтому выражение для константы равновесия упрощается:
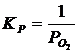 ;
;
Дальнейшие расчёты аналогичны предыдущему.
в) Фазовое равновесие XI:
α – Mn0,85Si0,15– MnO
Уравнение реакции, соответствующее данному равновесию:
2Mn(α)+O2=2MnO
Константа равновесия реакции (3):
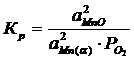 ;
;
Мольная доля чистого вещества равна единице, поэтому выражение для константы равновесия упрощается:
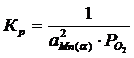 (4)
(4)
Равновесие MnO с альфа-фазой является моновариантным, поэтому давление кислорода в газовой фазе, равновесной с конденсированной фазой, будет зависеть от активности марганца в альфа-фазе. Однозначно определить его можно, например, для точки, соответствующей предельной растворимости кремния в марганце. В этой точке мольная доля кремния ![]() ,
, ![]() и
и ![]() .
.
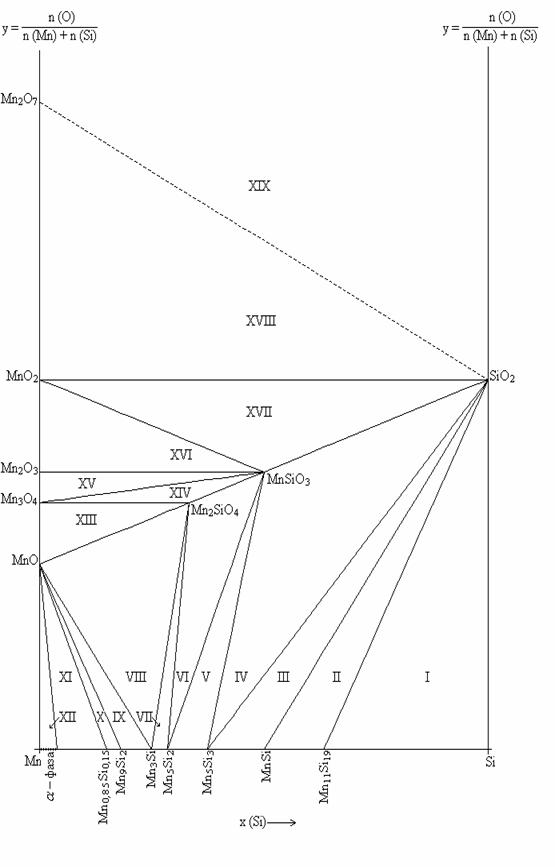
Рис.2.1. Фазовая диаграмма состояния системы Mn-Si-O при 25 0С.
Таблица 2.8 Характеристики фазовых равновесий системы Mn-Si-O при 25 0С
|
№ |
Равновесие |
Уравнение реакции |
|
Равновесный состав фаз | ||||
|
I |
Si – Mn11Si19 – SiO2 |
Si(A) + O2 = SiO2 |
|
| ||||
|
II |
Mn11Si19 – MnSi – SiO2 |
Mn11Si19 + 8O2 = 11MnSi + 8SiO2 |
|
| ||||
|
III |
MnSi– Mn5Si3– SiO2 |
5MnSi + 2O2 = Mn5Si3 + 2SiO2 |
|
| ||||
|
IV |
Mn5Si3 – MnSiO3– SiO2 |
2Mn5Si3 + 4SiO2 + 11O2 = 10MnSiO3 |
|
| ||||
|
V |
Mn5Si3 – Mn5Si2–MnSiO3 |
6Mn5Si3 + 15O2 = 4Mn5Si2 + 10MnSiO3 |
|
| ||||
|
VI |
Mn5Si2–MnSiO3–Mn2SiO4 |
2Mn5Si2 + 2MnSiO3 + 9O2 = 6Mn2SiO4 |
|
| ||||
|
VII |
Mn5Si2– Mn3Si – Mn2SiO4 |
Mn5Si2 + 2O2 = Mn3Si + Mn2SiO4 |
|
| ||||
|
VIII |
Mn3Si –Mn2SiO4 - MnO |
2Mn3Si + 5O2 = 2Mn2SiO4 + 2MnO |
|
| ||||
|
IX |
Mn9Si2 – Mn3Si – MnO |
2Mn9Si2 + 3O2 = 4Mn3Si + 6MnO |
|
| ||||
|
X |
Mn0,85Si0,15–Mn9Si2–MnO |
80Mn0,85Si0,15 + 7O2 = 6Mn9Si2 + 4MnO |
|
| ||||
|
XI |
α – Mn0,85Si0,15– MnO |
2Mn(α)+O2=2MnO |
|
| ||||
|
XII |
α– MnO | |||||||
|
XIII |
MnO – Mn3O4 – Mn2SiO4 |
6MnO + O2 = 2Mn3O4 |
|
| ||||
|
XIV |
Mn3O4–Mn2SiO4–MnSiO3 |
6Mn2SiO4 + O2 = 6MnSiO3 + 2Mn3O4 |
|
| ||||
|
XV |
Mn3O4 – Mn2O3 – MnSiO3 |
4Mn3O4 + O2 = 6Mn2O3 |
|
| ||||
|
XVI |
Mn2O3 – MnO2 – MnSiO3 |
2Mn2O3 + O2 = 4MnO2 |
|
| ||||
|
XVII |
MnO2 – MnSiO3 – SiO2 |
2MnSiO3 + O2 = 2MnO2 + 2SiO2 |
|
| ||||
|
XVIII |
MnO2 – Mn2O7 – SiO2 |
4MnO2 + 3O2 = 2Mn2O7 |
|
| ||||
|
XIX |
Mn2O7–SiO2–{O2} | |||||||
Смотрите также
Свойства азота
Азот – элемент с седьмым
порядковым номером, относящийся к V главной подгруппе второго периода системы.
По распространенности в земной коре азот занимаем 31-е место – 0,025% (по
другим данн ...
Разработка основ технологии и оборудования для электрохимического производства нитрата графита
...


