Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Расчет и построение диаграммы состояния Mn-Si-O при 250С. Анализ химической
устойчивостиДипломы, курсовые и прочее / Термодинамика химической устойчивости сплавов системы Mn-Si / Дипломы, курсовые и прочее / Термодинамика химической устойчивости сплавов системы Mn-Si / Расчет и построение диаграммы состояния Mn-Si-O при 250С. Анализ химической
устойчивости Расчет и построение диаграммы состояния Mn-Si-O при 250С. Анализ химической
устойчивостиСтраница 1
Как следует из экспериментальных данных по системе марганец-кремний (рис.1.1), кремний-кислород (рис.1.4) и марганец-кислород (рис.1.5) в системе Mn-Si-O можно предположить существование областей, в которых присутствуют следующие фазы (поскольку химическое сродство кремния к кислороду выше, чем марганца, то вероятнее, что почти при любом составе сплава Mn-Si в первую очередь будет реализовываться равновесие сплав – SiO2):
1. Si(γ) – Mn11Si19 – SiO2; (I)
2. Mn11Si19 – MnSi –SiO2; (II)
3. MnSi – Mn5Si3 – SiO2; (III)
4. Mn5Si3 – Mn5Si2 – SiO2; (IV)
5. Mn5Si2– Mn3Si – SiO2; (V)
6. Mn3Si – Mn9Si2 – SiO2; (VI)
7. Mn9Si2 – R(Mn6Si) – SiO2; (VII)
8. R(Mn6Si) – α-фаза – SiO2; (VIII)
9. α-фаза – SiO2; (IX)
10. α-фаза ––MnSiO3–SiO2; (X)
11. α-фаза ––Mn2SiO4–MnSiO3; (XI)
12. α-фаза ––MnO– Mn2SiO4; (XII)
13. MnO–Mn3O4– Mn2SiO4; (XIII)
14. Mn3O4– Mn2SiO4– MnSiO3; (XIV)
15. Mn3O4–Mn2O3– MnSiO3; (XV)
16. Mn2O3– MnSiO3–SiO2; (XVI)
17. Mn2O3–MnO2–SiO2; (XVII)
18. MnO2–Mn2O7–SiO2; (XVIII)
19. Mn2O7–SiO2–{O2}; (XIX)
Для того, чтобы однозначно определить инвариантное состояние системы, необходимо задать равновесные составы сосуществующих фаз и давление кислорода в газовой фазе, равновесной с конденсированными фазами.
Примеры расчета:
а) Фазовое равновесие V: Mn5Si2– Mn3Si – SiO2
Уравнение реакции, соответствующее данному равновесию:
![]() (1)
(1)
Константа равновесия реакции (1):
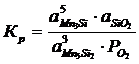 ; (2.1)
; (2.1)
Мольные доли компонентов равны единице, поэтому выражение для константы равновесия упрощается:
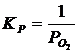 ; (2.2)
; (2.2)
Уравнение изотермы химической реакции:
![]() ; (2.3)
; (2.3)
Энергия Гиббса реакции (1) рассчитывается по формуле:
![]() ; (2.4)
; (2.4)
С учетом уравнения (2.2):
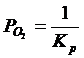
б) Фазовое равновесие X:
α-фаза ––MnSiO3–SiO2 было описано независимыми реакциями образования SiO2 и MnSiO3 из компонентов α-фазы (Mn, Si) и компонентов газовой фазы O2:
(1) ![]() ;
;
(2) ![]() ;
;
![]()
![]()
Константы равновесия реакций 1 и 2:
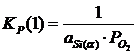 ; (2.3)
; (2.3)
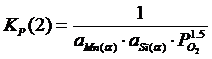 ; (2.4)
; (2.4)
Для определения состава α-фазы исключим ![]() из конечного термодинамического уравнения. Для этого возведем уравнение (2.3) в куб и поделим полученное на уравнение (2.4), получим:
из конечного термодинамического уравнения. Для этого возведем уравнение (2.3) в куб и поделим полученное на уравнение (2.4), получим:
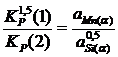 ; (2.5)
; (2.5)
Это уравнение можно переписать в виде:
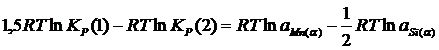 ; (2.6)
; (2.6)
Из уравнения изотермы химической реакции:
![]() ; (2.7)
; (2.7)
уравнение (2.3.4) можно переписать:
![]() ; (2.8)
; (2.8)
Данное трансцендентное уравнение можно решить только численным методом. Обозначив ![]() ,
, ![]() , получим:
, получим:
![]() ; (2.9)
; (2.9)
![]() ; (2.10)
; (2.10)
Подставив уравнения (2.9) и (2.10) в (2.8) решаем численным методом, находим значение х. Исходя из уравнений (2.3) или (2.4) определяем величину ![]() .
.
Смотрите также
Химические волокна
За последние 100 лет население Земли удвоилось. Но еще
больше возросли потребности людей. Выработка природных волокон – шерсти,
хлопка, натурального шелка, льна, конопли – стала заметно отст ...


