Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Анализ результатовДипломы, курсовые и прочее / Роль свободных радикалов в природной среде / Дипломы, курсовые и прочее / Роль свободных радикалов в природной среде / Анализ результатов Анализ результатовСтраница 1
Предположительно, источником подщелачивания являлись окислительно-восстановительные реакции с участием перекиси водорода. Разложение перекиси водорода в водных растворах происходит непрерывно под влиянием разнообразных физико-химических воздействий: тепла, света, кавитации и т.п. Восстановление ![]() может происходить либо через диссоциацию с образованием гидроксил-иона и гидроксильного радикала, либо через протонирование и распад на воду и гидроксильный радикал.
может происходить либо через диссоциацию с образованием гидроксил-иона и гидроксильного радикала, либо через протонирование и распад на воду и гидроксильный радикал.
Известно, что гидроксильный радикал является самым реакционноспособным окислителем в природной среде и способен реагировать практически со всеми растворенными в воде органическими и неорганическими веществами. Основные пути превращения гидроксильных радикалов в водных растворах — это отрыв водорода от органических соединений с образованием воды и органического радикала, гидроксилирование ненасыщенных органических соединений и реакции одноэлектронного переноса с анионами. В результате подобных радикальных перегруппировок образуются более стабильные и долгоживущие радикалы. Рекомбинация углеродсодержащих радикалов приводит в конечном итоге к появлению органических соединений, и это служило причиной образования осадка в проводившихся опытах. Образование подобного осадка рыжевато-коричневого цвета имело место как в чистых растворах гидрокарбонатов, так и в водопроводной воде при длительном отстаивании.
В речной воде образующийся осадок, как правило, более темный, что связано с включением в процессы радикальных превращений фрагментов гумусовых соединений, присутствующих в значительных количествах в природных водах.
Если в водных растворах преобладают карбонаты и гидрокарбонаты, то восстановление гидроксильных радикалов наиболее вероятно по следующей схеме:
![]()
Лимитирующим фактором реакции (1) является активность гидроксильных радикалов, концентрация которых в природных водах составляет ![]() моль/л. В случае добавления перекиси водорода концентрация гидроксил-ионов должна увеличиться, и эффект подщелачивания в результате реакции (1) станет более заметным. Факторы, ускоряющие процесс разложения
моль/л. В случае добавления перекиси водорода концентрация гидроксил-ионов должна увеличиться, и эффект подщелачивания в результате реакции (1) станет более заметным. Факторы, ускоряющие процесс разложения ![]() , в том числе солнечный свет, должны усиливать подщелачивание. Именно такое поведение растворов и наблюдалось в проводившихся опытах (см. кривые 1, 4, 5).
, в том числе солнечный свет, должны усиливать подщелачивание. Именно такое поведение растворов и наблюдалось в проводившихся опытах (см. кривые 1, 4, 5).
В качестве восстановителей и одновременно катализаторов процесса могут выступать металлы переменной валентности, в том числе железо (общая концентрация ионов железа в речной воде составляет 0,2-1,2 мг/л). Полная схема катализа ионами железа распада перекиси водорода представлена ниже. Логарифмы скоростей реакций приведены для температуры 298 К.
свободный радикал стратосфера тропосфера
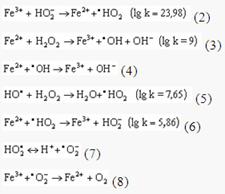
В растворе без доступа света преобладают наиболее быстрые реакции (2) и (3), что и является причиной подщелачивания среды (см. кривую 5). Под действием света происходит фотодиссоциация перекиси водорода, концентрация гидроксильных и гидроперекисных радикалов возрастает — и начинает заметно сказываться влияние реакций (4)-(6), что существенно ускоряет ход процесса (см. кривую 4). Реакции (7), (8), способствующие подкислению среды, по-видимому, являются второстепенными, хотя с повышением рН их роль может усиливаться.
Окислительно-восстановительные системы подобной структуры помимо переходных металлов образуют и органические соединения, в частности гидрохинон. Установлено, что гидрохинон является экзометаболитом некоторых видов бактерий, так что его присутствие в речной воде и участие в процессах каталитического разложения ![]() вполне закономерно.
вполне закономерно.
Генерация свободных радикалов в природных водах может происходить и без участия перекиси водорода. Причем в роли инициаторов могут активно выступать органические соединения, характерные для речной воды. Такие процессы происходят в гумусовых веществах в результате фотовозбуждения карбонильных групп до так называемых n- p-триплетных состояний. Возможен и вариант фотоэлектронного переноса, когда супероксид-ион образуется непосредственно из растворенного в воде кислорода. Подобные реакции часто осуществляются в молекулах красителей и фульвокислот.
Смотрите также
Исследование совместного электровосстановления гадолиния и
алюминия в галогенидных расплавах.
Из анализа
литературных данных следует, что процесс электровосстановления алюминия из
хлоридных и фторидных расплавов изучался в основном на платиновом электродах.
Электровосстановление
алюминия ...
Особенности синтеза и производства витаминов
Производство
витаминов в нашей стране организовано в начале 30-х гг прошлого века. Вначале
выпускались витаминные препараты из натурального сырья. Затем было освоено
производство синтетичес ...
Самоорганизация ион-проводящих структур при протекании электрохимических процессов на фазовых переходах, включающих серосодержащие компоненты
Актуальность темы
диссертации.
Тема диссертационной
работы относится к электрохимии твердого состояния, входящей как составная
часть в ионику твердого тела (ИТТ) -раздел науки, возникший ...


