Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электролитическая диссоциация воды. Водородный показательДипломы, курсовые и прочее / О растворах / Дипломы, курсовые и прочее / О растворах / Электролитическая диссоциация воды. Водородный показатель Электролитическая диссоциация воды. Водородный показатель
Вода является слабым электролитом, который диссоциирует по уравнению: ![]() .
.
Это явление называется самоионизацией или автопротолизом.
Константа диссоциации воды при 250 С составляет:
![]()
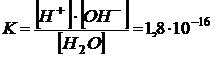
Так как константа диссоциации воды очень мала, можно считать концентрацию воды постоянной величиной:
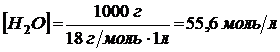
Тогда:
![]()
![]() (при 295 К)
(при 295 К)
Величина Kw называется ионным произведением воды.
Ионное произведение воды характеризует равновесие между ионами водорода и гидроксид-ионами в водных растворах и является постоянной при данной температуре величиной.
Кислотность или основность водного раствора может быть выражена концентрацией ионов водорода или гидроксид-ионов. Чаще всего для этой цели используют величину рН, которая связана с концентрацией ионов водорода следующим соотношением:
![]()
В нейтральной среде:
![]() ; рН = 7
; рН = 7
В кислой среде:
![]() ; рН < 7
; рН < 7
В щелочной среде:
![]() ; рН > 7
; рН > 7
Зная рН, легко рассчитать рОН, и наоборот, т.к.: рН + рОН = 14.
Расчёт рН и рОН растворов сильных и слабых электролитов.
Концентрацию ионов Н+ определяют по уравнению Оствальда: [H+]=![]() ; аналогично для гидроксила: [ОH–]=
; аналогично для гидроксила: [ОH–]=![]() ;
;
Смотрите также
Подготовительные работы в кабинете химии
...
Определение неоднородности целлюлозы по молекулярной массе
Целлюлоза, как и другие полимеры, представляет
собой смесь полимергомологов с различной длиной макромолекул, т.е. неоднородна
по молекулярной массе. Неоднородность целлюлозы по молекулярной ...
Обсуждение результатов
Для химического
исследования снежного покрова, нами был проведен отбор проб на следующих
объектах: поселок Шлаковый, поселок Мирный, м-н. Кольное, пл. Ленина, пл.
Театральная, ЦПКиО, м-н. Канищево, ...


