Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Термодинамика протекания электродных процессов.
Самопроизвольность протекания окислительно-восстановительных реакций. Связь ЭДС
гальванического элемента с энергией Гиббса. Связь ЭДС с константой равДипломы, курсовые и прочее / Общая и неорганическая химия / Дипломы, курсовые и прочее / Общая и неорганическая химия / Термодинамика протекания электродных процессов.
Самопроизвольность протекания окислительно-восстановительных реакций. Связь ЭДС
гальванического элемента с энергией Гиббса. Связь ЭДС с константой рав Термодинамика протекания электродных процессов.
Самопроизвольность протекания окислительно-восстановительных реакций. Связь ЭДС
гальванического элемента с энергией Гиббса. Связь ЭДС с константой равСтраница 6
-ДH = 217760 Дж, а E = 1,015 В при 0° C. Отсюда
-Q = -ДH = 217760 - 2·96493·1,015 = 21880 Дж.
dE/dT = -218807(273·2·96493) −∼ - 4·10-4 В/К.
Примером элемента с положительным температурным коэффициентом является ячейка Hg ∣ Hg2Cl2, KCl ∣ KOH ∣ Hg2O ∣ Hg, в которой протекает реакция Hg2Cl2 + 2KOH = 2KCl + Hg2O + H2O.
Левый электрод этого элемента называемый каломельным, часто используется в электрохимических измерениях. Он состоит из жидкой ртути, находящейся в контакте с твердой каломелью Hg2Cl2 и водным раствором какого-либо сильного электролита, например KС1. Реакция, идущая в рассматриваемом элементе, является эндотермической, ДH = 13720 Дж, а W = 31570 Дж. Таким образом Q = 13720 + 31570 = 45240 Дж, т.е. элемент поглощает из окружающей среды тепло, равное 45240 Дж. Часть этого тепла, равная 31570 Дж, идет на производство работы.
Зависимость э. д. с. от концентраций электролитов, участвующих в реакции, может быть: найдена при помощи уравнения изотермы химической реакции.
Пусть в гальваническом элементе протекает реакция A + B = 2D, при этом ДG = RTlnK + RTln (c 2 D/cAcB). Подставляя вместо ДG величину - nEF и разделив обе части уравнения на -пF, получим E = RTln(K/nF) - [RT/nFln (c 2D/cAcB)]. или, обозначая величину RTlnK/nF, зависящую только от температуры, через E0, будем иметь:
E = E0 - (RT/nF[ln(c 2 D/ cAcB)]. (IX.7.)
Величина E0 называется стандартной э. д. с. элемента. Она характеризует элемент, в котором концентрации всех участвующих в реакции веществ равны единице, а изменение энергии Гиббса равно стандартному ДG0. Заменив в уравнении (IX.7) натуральный логарифм десятичным, получим для температуры 25 °C.
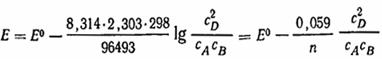
Очевидно, что для электролитов нельзя просто пользоваться аналитическими концентрациями соответствующих веществ, а необходимо учитывать диссоциацию и взаимодействие ионов. В связи с этим возникает задача определения активности электролитов.
Смотрите также
Деформируемые алюминиевые сплавы
Металловедение – наука,. Изучающая строение
и свойства металлов и устанавливающая связь между их составом, строением и
свойствами.
В данном реферате приведены общие и
теоретические сведе ...
Химико-токсикологический анализ лекарственных средств, производных фенотиазина
В России и за рубежом, начиная с 1945 г., после обнаружения фармакологической активности N-замещенных производных фенотиазина, было синтезировано большое число
препаратов, обладающих нейролеп ...
Красители на основе 2-амино-5-меркапто-1,3,4-тиадиазола
Красителями, в широком смысле этого слова, называют
органические соединения, обладающие способностью поглощать и преобразовывать
световую энергию в видимой и ближних ультрафиолетовой и инфра ...


