Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Термодинамика протекания электродных процессов.
Самопроизвольность протекания окислительно-восстановительных реакций. Связь ЭДС
гальванического элемента с энергией Гиббса. Связь ЭДС с константой равДипломы, курсовые и прочее / Общая и неорганическая химия / Дипломы, курсовые и прочее / Общая и неорганическая химия / Термодинамика протекания электродных процессов.
Самопроизвольность протекания окислительно-восстановительных реакций. Связь ЭДС
гальванического элемента с энергией Гиббса. Связь ЭДС с константой рав Термодинамика протекания электродных процессов.
Самопроизвольность протекания окислительно-восстановительных реакций. Связь ЭДС
гальванического элемента с энергией Гиббса. Связь ЭДС с константой равСтраница 4
Zn ∣ ZnSO4 ∥ CuSO4 ∣ Cu.
Принято записывать подобные схемы таким образом, чтобы левый электрод был отрицательным (электроны текут по металлическому проводнику слева направо и в том же направлении переносится ионами положительное электричество внутри элемента). Такая запись отвечает протеканию реакции, сопровождающейся убылью энергии Гиббса и положительной величине э. д. с.
Гальванические элементы могут быть построены не только с использованием водных растворов электролитов, но и с, применением расплавов. Примером такого элемента может служить цепь Ag ∣ AgBr ∣ Br2, в которой левый электрод серебряный, а правый - представляет собой графит, омываемый газообразным бромом, а электролитом является расплавленное AgBr. На левом электроде растворяется серебро: Agт → Ag+ + e, а на правом - адсорбированный графитом бром: 1/2Br2г + e = Br-. Таким образом, в элементе происходит реакция: Agт + 1/2Br2г = AgBrж.
В последнее время приобрели большое значение гальванические элементы с твердыми электролитами, имеющими кислородную проводимость (см. гл. VIII), например,
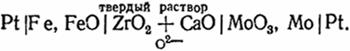
Левый электрод представляет собой смесь железа и его оксида. Здесь происходит реакция окисления железа ионами О2-, приходящими через твердый электролит. При этом освобождаются электроны, и электрод получает отрицательный заряд. На правом электроде, состоящем из смеси Мо и МоО3, происходит восстановление оксида. Это сопровождается поглощением электронов таким образом, что электрод заряжается положительно, а освободившиеся ионы О2 могут мигрировать через электролит к левому электроду. Реакция на электроде изображается следующим уравнением 3Feт + 3О2- = 3FеОт + 6е; на правом электроде: МоО3т + 6е = Мот + 3О2-.
Заметим, что сумма этих двух реакций 3Fет + МоОт = 3FеОт + Мот есть процесс восстановления оксида молибдена железом, самопроизвольное протекание которого является источником электрической энергии производимой элементом.
Из рассмотренных примеров видно, что реакцию, протекающую в гальваническом элементе, можно представить в виде двух отдельных электродных реакций.
Можно предположить, что э. д. с. гальванического элемента должна зависеть от природы реагирующих веществ, их концентраций и температуры. Чтобы найти выражения для этих зависимостей, необходимо рассмотреть термодинамические соотношения, характеризующие работу гальванического элемента.
Пусть в гальваническом элементе протекает реакция: M + Nn+ = Mn+. Работа, производимая элементом при расходе 1 моля М, определяется произведением количества электричества nF на величину э. д. с. Е, т.е. W = nFE, где п - число молей электронов, протекающих через цепь; F - число Фарадея, равное 96493 Кл. Например, для реакции Zn + Cu2+ = Zn2+ + Cu, n = 2. Если элемент работает обратимо при постоянных давлении и температуре, то произведенная им работа равна убыли энергии Гиббса, т.е. ДG = W:
ДG = -nFE = -96493E. (IX.1)
Если элемент работает необратимо, то nFE < -ДG, т.е. э.д.с. меньше, чем при обратимом проведении реакции. Выражая E в В, получаем величину ДG в Дж.
Таким образом, если известно стехиометрическое уравнение протекающей в гальваническом элементе реакции и табличные данные об изменении энергии Гиббса, можно рассчитать э. д. с.
Так, для рассмотренного выше водородно-кислородного элемента, работающего за счет энергии, освобождающейся при реакции Н2г + 1/2О2г = Н2Ож, для которой ДG 0
298 = -237200 Дж, п = 2, рH2 = рO2 = 1.
E = -ДG 0
298
/n·96493 = -(-237200/2)·96493 −∼ 1,2 В.
Смотрите также
Алхимия как феномен культуры
На современном
этапе научное познание мира происходит в соответствии с концепцией
естествознания — совокупности естественных наук, которые изучают явления и
процессы, происходящие в мире, в ...
Разработка основ технологии и оборудования для электрохимического производства нитрата графита
...


