Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Установление структурыДипломы, курсовые и прочее / Витамин С: структура, химические свойства, значение / Дипломы, курсовые и прочее / Витамин С: структура, химические свойства, значение / Установление структуры Установление структурыСтраница 1
На этот раз бирмингемская группа имела в своем распоряжении достаточное количество кристаллов. Были известны молекулярная формула соединения (С6H8O6), точка плавления (191°С) и угол оптического вращения (+23° в воде). Тем не менее расшифровка структуры потребовала увлекательной, почти детективной работы, так характерной для органической химии в те легендарные годы. Ответственность за работу была возложена на Эдмунда Херста, который работал под руководством Хеуорса еще в Дареме.
При кипячении в соляной кислоте кристаллы давали фурфурол с количественным выходом, что свидетельствовало о том, что по крайней мере пять из шести атомов углерода образуют неразветвленную цепь. Дальнейшие опыты показали, что аскорбиновая кислота является слабой одноосновной кислотой и сильным восстановителем. Первая стадия окисления, которая легко обратима, может быть проведена с помощью водного раствора иода, подкисленного бензохиноном, или молекулярного кислорода в присутствии солей меди при рН 5. Продукт окисления, которое приводило к отщеплению двух атомов водорода, был назван дегидроаскорбиновой кислотой (С6Н6Об)- Обратимое окисление иодом протекало аналогично известной реакции с 2,3-дигидроксималеиновой кислотой:
НООСС(ОН) = С(ОН)СООН + I2 →НООССО - СОСООН + 2HI
что позволяло предположить наличие ендиольной группировки С(ОН) = С(ОН). Сходство в спектрах поглощения аскорбиновой
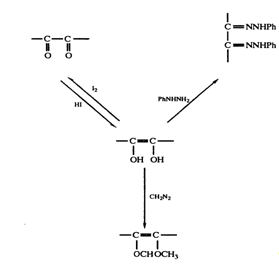
Рис. 1. Реакции ендиольной группировки.
и дегидроксималеиновой кислот с единственной интенсивной полосой при 245 нм подтвердило это предположение. В дальнейшем присутствие ендиольной группировки было доказано следующим образом: 1) при обработке диазометаном получалась диметиласкорбиновая кислота; 2) взаимодействие с фенилгидразином после первоначального окисления приводило к образованию озазона (рис. 3.1). Первоначально кислотные свойства аскорбиновой кислоты приписывались наличию карбоксильной группы. Однако было показано, что дегидроаскорбиновая кислота — это нейтральный лактон, который медленно гидролизуется, высвобождая карбоксильную группу. Легкость взаимных превращений дегидроаскорбиновой и аскорбиновой кислот указывала на то, что
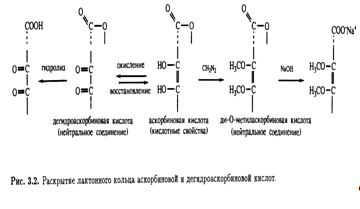
последняя также является лактоном. Эта точка зрения подкреплялась и тем фактом, что диметиласкорбиновая кислота, будучи нейтральным соединением, при обработке гидроксидом натрия дает натриевую соль без отщепления метильной группы, т. е. происходит раскрытие лактонного кольца (рис. 3.2).
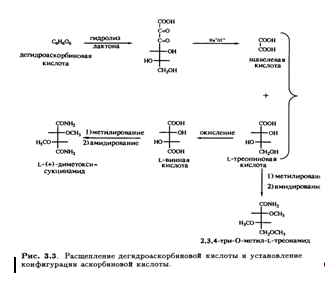
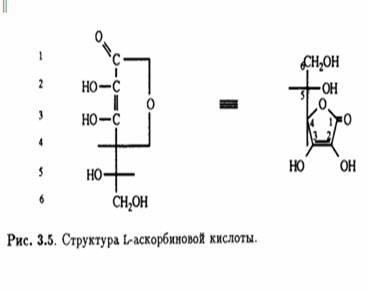
Кроме того, было известно, что в молекуле присутствуют еще две спиртовые ОН-группы, которые при обработке ацетоном образуют производное изопропилидена, также содержащее два енольных гидроксила. Дальнейшее окисление дегидроаскорбиновой кислоты гипоиодитом натрия в щелочной среде приводит к образованию щавелевой и L-треониновой кислот, причем последняя была идентифицирована по ее последовательным превращениям в известные со соединения — L-диметоксисукцинамид и три-О-метил-ь-треонамид. Описанные превращения помогли установить стереохимическое родство природной L-аскорбиновой кислоты и углеводов L-ряда, а также выяснить, что карбонильная группа лактона соседствует непосредственно с ендиольной группировкой (рис. 3.3). Теперь необходимо было выяснить размер лактонного кольца, и это удалось сделать в результате еще одного простого эксперимента. Было известно, что при обработке диазометаном L-аскорбиновая кислота превращается в ди-О-метильное производное. Дальнейшее метилирование иодметаном в присутствии оксида серебра приводит к образованию тетра-О-метилированного соединения, озонолиз которого дает единственный продукт — нейтральный эфир. Под действием аммиака в метаноле эфир деградирует с образованием амида щавелевой кислоты и 3,4-ди-О-метил-Ь-треонамида; последний был идентифицирован по характерной для 2-гидроксиамидов реакции Веермана. Так было показано, что лактонное кольцо замыкается по положению С-2 треонамида, эквиэквивалентного положению С-4 тетра-О-метиласкорбиновой кислоты (рис. 3.4). Таким образом было установлено, что аскорбиновая кислота является 7-лактоном, который изображен на рис. 3.5.
Надо отметить, что в растворе в небольших количествах могут присутствовать и другие таутомерные формы. Асимметрический центр при С-5 имеет L- конфигурацию (или S-конфигурацию согласно системе Кана — Ингольда — Прелога). Кислотные свойства раствора аскорбиновой кислоты обусловлены ионизацией ендиольного гидроксила при С-3 (рКа 4,25), что приводит к делокализации отрицательного заряда в образующемся анионе.
Смотрите также
Способы восстановления оксидов азота
Основными источниками загрязнения атмосферного воздуха
являются промышленные предприятия, транспорт, тепловые электростанции,
животноводческие комплексы. Каждый из этих источников связан с в ...
Галогены
Галогены
(от греч. halos – соль и genes – рождающий, рождённый) находятся в главной
подгруппе VII группы периодической системы химических элементов.
К
галогенам относят фтор, хлор, бром, ...
Азотная кислота
...


