Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Химические
свойства аминокислотСтатьи и работы по химии / Аминокислоты / Статьи и работы по химии / Аминокислоты / Химические
свойства аминокислот Химические
свойства аминокислот
Все a-аминокислоты, кроме глицина, содержат хиральный a-углеродный атом и могут встречаться в виде энантиомеров:

Было доказано, что почти все природные a-аминокислоты обладают одной и той же относительной конфигурацией при a-углеродном атоме. a-Углеродному атому (-)-серина была условно приписана L-конфигурация, а a-углеродному атому (+)-серина - D-конфигурация. При этом, если проекция a-аминокислоты по Фишеру написана так, что карбоксильная группа расположена сверху, а R - внизу, у L-аминокислоты аминогруппа будет находиться слева, а у D-аминокислоты - справа. Схема Фишера для определения конфигурации аминокислоты применима ко всем a-аминокислотам, обладающим хиральным a-углеродным атомом.

Из рисунка видно, что L-аминокислота может быть правовращающей (+) или левовращающей (-) в зависимости от природы радикала. Подавляющее большинство a-аминокислот, встречающихся в природе, относится к L-ряду. Их энантиоморфы, т.е. D-аминокислоты, синтезируются только микроорганизмами и называются «неприродными» аминокислотами.
Согласно номенклатуре (R,S), большинство «природных» или L-аминокислот имеет S-конфигурацию.

L-Изолейцин и L-треонин, содержащие по два хиральных центра в молекуле, могут быть любыми членами пары диастереомеров в зависимости от конфигурации при b-углеродном атоме. Ниже приводятся правильные абсолютные конфигурации этих аминокислот.
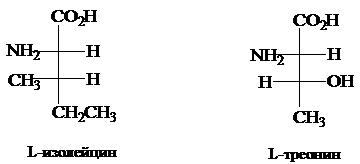
Смотрите также
Заключение
При написании работы
был изучен метод потенциометрического титрования. В результате можно выделить несколько
основных преимуществ данного метода титрования перед методом кислотно-основного
титрован ...
Производство поливинилбутираля
Химическая
промышленность прошла бурный путь развития в период 50-х – 80-х годов. В
отрасли был создан значительный производственный потенциал. Однако он был
ориентирован на цели командно–а ...


