Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислотно-основные свойства
химических соединенийОткрытая химия / Растворы / Открытая химия / Растворы / Кислотно-основные свойства
химических соединений Кислотно-основные свойства
химических соединенийСтраница 3
В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:
| |
Для многоосновных кислот способность к депротонизации уменьшается по мере увеличения отрицательного заряда аниона:
| |
При этом константа диссоциации каждой последующей ступени уменьшается примерно на пять порядков:
|
K1 : K2 : K3 = 1 : 10–5 : 10–10. |
На состояние динамического равновесия, в котором находится раствор слабого электролита, сильно влияет присутствие одноименного иона. Так, диссоциация уксусной кислоты протекает по схеме
| |
и для этой реакции
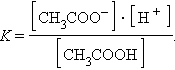 |
Прибавление к раствору уксусной кислоты ее соли (CH3COONa → CH3COO– + Na+) резко увеличивает концентрацию ионов CH3COO– и смещает равновесие в сторону образования недиссоциированных молекул кислоты. Ее диссоциация теперь пренебрежимо мала, и концентрация недиссоциированных молекул почти равна концентрации кислоты, тогда при [CH3COOH] = [кислота], и [CH3COO–] = [соль] концентрация H+ равна
| |
или
|
Следовательно, концентрация ионов H+ этого раствора будет определяться соотношением концентраций кислоты и соли, взятых для его приготовления.
Смотрите также
Правила отбора проб
Отбор проб
производится один раз в год в период максимального накопления влагозапаса в
снеге – I-II декаде марта
Для отбора снега
используются следующие вспомогательные устройства и материалы: с ...


