Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислотно-основные свойства
химических соединенийОткрытая химия / Растворы / Открытая химия / Растворы / Кислотно-основные свойства
химических соединений Кислотно-основные свойства
химических соединенийСтраница 2
Перемножив константы сопряженных кислот и оснований, получим
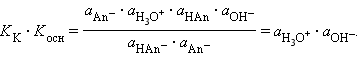 |
Заменив активности ![]() и
и ![]() на равновесные концентрации, получим
на равновесные концентрации, получим
|
Произведения констант диссоциации сопряженных кислот и оснований в водных растворах равно ионному произведению воды. По известным KK(Kосн) можно легко найти значения сопряженных KВ.
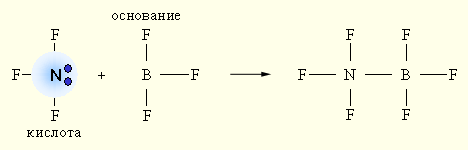
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару.
При взаимодействии донора электронной пары: NF3 (кислота) и акцептора электронной пары BF3 (основание) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной (двухэлектронной двухцентровой) связи.
 |
|
Рисунок 6.8 |
Ни кислота, ни основание протонов не содержат.
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.
В периоде сила кислородсодержащей кислоты растет с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента:
| |
Для одного и того же элемента константа диссоциации различных кислот возрастает по мере увеличения степени окисления кислотообразующего элемента примерно на пять порядков каждый раз.
| |
Смотрите также
Активные угли и их промышленное применение
С развитием промышленного производства активного угля
в начале нашего столетия применение этого продукта неуклонно возрастает. В
настоящее время активный уголь используется во многих процесс ...
Методика проведения потенциометрического титрования.
Рассмотрим процесс
потенциометрического титрования сильной кислоты раствором сильной щелочи. ...
Железо
В периодической системе
железо находится в четвертом периоде, в побочной подгруппе VIII группы.
Химический знак – Fe (феррум). Порядковый
номер – 26, электронная формула 1s2 2s2 2p6
3d6 ...


