Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Расчёт термодинамических функцийУчим химию / Получение уксусной кислоты / Учим химию / Получение уксусной кислоты / Расчёт термодинамических функций Расчёт термодинамических функцийСтраница 2
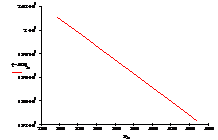
Рис.7 Зависимость изменения энергии Гиббса ΔG от температуры
Пользуясь уравнением изотермы Вант-Гоффа:
ΔG = – RT•lnkp,
вычислим значения констант равновесия:
lnkp = – ΔG /(RT)
|
Т, К |
313 |
328 |
343 |
358 |
363 |
378 |
393 |
408 |
433 |
448 |
|
lnkp |
76,9388 |
73,1007 |
69,5973 |
66,3866 |
65,7352 |
62,5208 |
59,8453 |
57,3843 |
53,6606 |
51,6252 |
|
kp |
2,59•1033 |
5,59•1031 |
1,68•1030 |
6,78•1028 |
2,47•1028 |
1,39•1027 |
9,78•1025 |
8,35•1024 |
2,02•1023 |
2,63•1022 |
Сведём полученные данные в таблицу термодинамических функций реакции:
|
Т, КТ, К |
298 |
313 |
328 |
343 |
358 |
363 |
378 |
393 |
408 |
433 |
448 |
|
–ΔН° Т кДж/моль |
218,3 |
218,37 |
218,43 |
218,49 |
218,55 |
218,57 |
218,63 |
218,68 |
218,74 |
218,82 |
218,86 |
|
–ΔS° Т Дж/моль |
57,77 |
57,98 |
58,19 |
58,37 |
58,54 |
58,60 |
58,75 |
58,89 |
59,03 |
59,22 |
59,32 |
|
–ΔG° Т кДж/моль |
201,08 |
200,22 |
199,35 |
198,47 |
197,59 |
197,30 |
196,42 |
195,54 |
194,65 |
193,18 |
192,29 |
|
kp |
1,77•1035 |
2,59•1033 |
5,59•1031 |
1,68•1030 |
6,78•1028 |
2,47•1028 |
1,39•1027 |
9,78•1025 |
8,35•1024 |
2,02•1023 |
2,63•1022 |
Смотрите также
Нефть и технология ее переработки
...
Характеристика абсорбционных методов очистки отходящих газов от примесей кислого характера
Грандиозные
масштабы производственной деятельности человека привели к большим позитивным
преобразованиям в мире – созданию мощного промышленного и сельскохозяйственного
потенциала, широкому ...
Термодинамика химической и электрохимической устойчивости сплавов системы Ni-Si
Сплавы кремния с никелем относятся к группе аморфных
металлических сплавов [1]. Следствием их аморфной структуры являются необычные магнитные,
механические, электрические свойства и высокая ...


