Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Уравнение Ван-дер-ВаальсаСтатьи и работы по химии / P-V-T соотношения: реальный газ и идеальный газ / Статьи и работы по химии / P-V-T соотношения: реальный газ и идеальный газ / Уравнение Ван-дер-Ваальса Уравнение Ван-дер-ВаальсаСтраница 2
Результаты расчета приведены в табл. 4.2 и на рис. 4.2.
Таблица 4.2
Давление изобутилбензола при 500, 657 и 1170 К, вычисленное по уравнению Ван-дер-Ваальса
|
V, см3/моль |
P, атм при температуре Т, К | ||
|
500 К |
657 К |
1170 К | |
|
100 |
-4227 |
-4339 |
-4705 |
|
200 |
-3703 |
-4561 |
-7367 |
|
300 |
53 |
204 |
699 |
|
400 |
-20 |
50 |
277 |
|
600 |
-1 |
33 |
142 |
|
800 |
10 |
32 |
104 |
|
900 |
12 |
31 |
92 |
|
1000 |
14 |
30 |
84 |
|
2000 |
13 |
21 |
44 |
|
3000 |
10 |
15 |
30 |
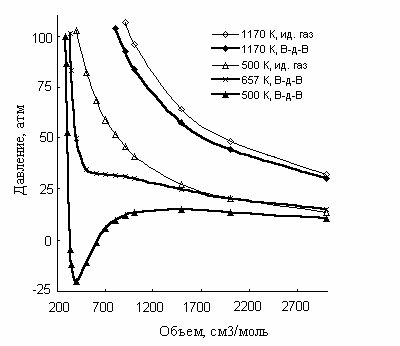
Р и с. 4.2. Сопоставление изотерм Ван-дер-Ваальса (В-д-В)
для изобутилбензола с изотермами идеального газа (ид. газ)
Анализ результатов, представленных на рис. 4.2, показывает, что изотермы реального газа имеют достаточно сложный вид. В области температур существенно выше критической вид изотермы для изобутилбензола близок к гиперболическому, так же как и для идеального газа. При температуре, ненамного превосходящей критическую, изотерма не имеет точки перегиба, но меняет свою кривизну. Область ниже критической температуры характеризуется наличием на изотерме экстремумов и резким изменением давления в диапазоне малых молярных объемов. В области больших молярных объемов вид изотермы для изобутилбензола совпадает с видом изотермы для идеального газа, рассчитанной по уравнению Ван-дер-Ваальса, только в области высоких значений мольного объема.
Смотрите также
Новейшие достижения современной химии
Химия
постоянно развивается как наука. И не только в теоретическом аспекте. На
нынешнем уровне развития человечества химические открытия приобрели огромное
практическое значение в самых раз ...
Переработка каучуков
Резиновые смеси на основе
фторкаучуков изготовляют и перерабатывают на обычном оборудовании. Из-за
повышенной жесткости каучуков и резиновых смесей и их сильного разогрева при
обработке загрузка об ...


