Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ЭнтропияОткрытая химия / Химическая термодинамика / Открытая химия / Химическая термодинамика / Энтропия ЭнтропияСтраница 2
Из табл. 4.1 следует, что энтропия зависит от: l агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию (вода, лед, пар). l изотопного состава (H2O и D2O). l молекулярной массы однотипных соединений (CH4, C2H6, н-C4H10). l строения молекулы (н-C4H10, изо-C4H10). l кристаллической структуры (аллотропии) – алмаз, графит.
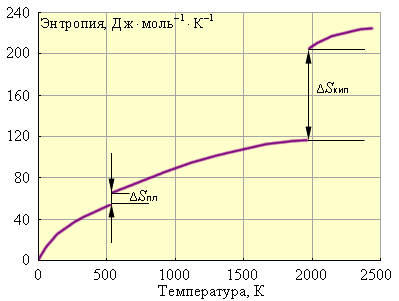
Наконец, рис. 4.3 иллюстрирует зависимость энтропии от температуры.
 |
|
Рисунок 4.3 Зависимость энтропии от температуры для свинца: ΔSпл = 8 Дж·моль–1·К–1; Tпл = 600,5 К; ΔSкип = 88 Дж·моль–1·К–1; Tкип = 2013 К |
Следовательно, стремление системы к беспорядку проявляется тем больше, чем выше температура. Произведение изменения энтропии системы на температуру T ΔS количественно оценивает эту тендецию и называется энтропийным фактором.
|
|
|
Модель 4.9. Реальный газ |