Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Соотношение линейности свободных энергий и структура переходного состоянияОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Соотношение линейности свободных энергий и структура переходного состояния Соотношение линейности свободных энергий и структура переходного состоянияСтраница 1
Уравнение Гаммета, устанавливая линейную связь между константами равновесий и (или) скоростей химических реакций, тем самым устанавливает линейную связь между свободными энергиями этих процессов (ΔGo или ΔG#). Таким образом, это уравнение отражает принцип линейности свободных энергий (принцип ЛСЭ). Этот принцип установлен исключительно на основе экспериментальных данных и не имеет априорного теоретического обоснования.
Если, например, сравниваются два равновесных процесса, то, поскольку ΔGo= -RTlnK, уравнение Гаммета можно записать следующим образом:
ΔGo=ρΔGo′+const.
Это выражение можно переписать в дифференциальной форме:
δΔGoZ=ρδΔGo′Z
и интерпретировать следующим образом.
Стандартная свободная энергия диссоциации самой бензойной кислоты ΔGo′ изменяется при введении заместителя Z в ароматическое ядро на величину δΔGo′. Этот же заместитель Z вызывает изменение стандартной свободной энергии ΔGo диссоциации другого ароматического соединения, например, фенилуксусной кислоты, на величину δΔGo. Уравнение Гаммета говорит нам, что изменения стандартных свободных энергий в различных реакциях, вызванные одним и тем же заместителем Z, пропорциональны между собой:
δΔGo пропорционально δΔGo′Z
и коэффициент пропорциональности ρ является сравнительной мерой чувствительности к введению заместителя второй реакции относительно чувствительности к такому же структурному изменению первой реакции.
Как уже отмечалось выше, исторически раньше уравнения Гаммета появилось уравнение Бренстеда, которое тоже является одной из форм выражения принципа ЛСЭ (разд. 3.3.7). В уравнении Бренстеда (3.23) и (3.24) lgk пропорционален свободной энергии активации каталитической реакции, а lgК - свободной энергии ионизации катализатора. Легко показать, что между уравнениями Бренстеда и Гаммета имеется тесная связь. Если круг катализаторов ограничить мета- и пара-замещенными бензойными кислотами, то, поскольку константы Гаммета определяются из значений рКа бензойных кислот, должна наблюдаться следующая корреляция:
lg(кZ/к0)=σρ=ρ[pKa(C6H5COOH)-pKa(ZC6H4COOH)].
Следовательно,
lgкZ=-ρpKa(C6H5COOH)+[lgк0+ρpKa(ZC6H4COOH)],
где кZ и к0 - скорости реакции при катализе замещенной и незамещенной бензойной кислотой соответственно.
Сумма в квадратных скобках для данной реакции постоянна (не зависит от Z). Это значит, что полученное уравнение имеет точную форму уравнения Бренстеда, если ρ=α. Но коэффициент Бренстеда, как уже упоминалось в разд. 3.3.7.б, может быть связан со строением переходного состояния (чем ближе α к 0, тем переходное состояние ближе к продуктам реакции). Отсюда следует, что величина константы ρ для кинетических корреляций тоже должна быть связана с положением переходного состояния на координате реакции. На самом деле ситуация сложнее.
При корреляции скоростей реакций по уравнению Гаммета константа ρ связана со структурой переходного состояния (точнее, с разностью свободных энергий между основным и переходным состояниями), отражая степень изменения (образования или исчезновения) электрического заряда на реакционном центре в переходном состоянии и степень отклика заместителя на это изменение. Тот факт, что соотношение ЛСЭ линейно, означает, что ρ - постоянная величина, характеристическая для данной реакции, и, следовательно, переходное состояние имеет одинаковую структуру, не зависящую от Z.
Это заключение диаметрально противоположно хорошо известному принципу физической органической химии, который называется постулатом Хэммонда. В своей простейшей формулировке постулат утверждает, что переходное состояние эндотермической стадии реакции похоже на продукты, а переходное состояние экзотермической стадии реакции похоже на реагенты. Слово "похоже" означается сходство структуры и близость по энергии; следовательно, экзотермическая реакция имеет низкую энтальпию активации, а эндотермическая реакция - высокую энтальпию активации, и чем более реакция экзотермична (или чем менее эндотермична), тем энтальпия активации ниже (рис. 3.15).
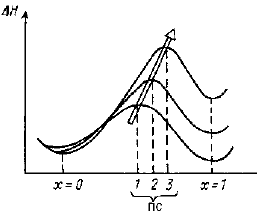
Рис. 3.15. Схематическое изображение постулата Хэммонда для трех реакций с разной экзотермичностью. ПС - переходное состояние; координата х=0 соответствует реагентам, а. х=1 - продуктам.
Смотрите также
Классификация взрывов по плотности вещества, по типам химических реакций
Горение - с детства и
навсегда поражающий наше воображение феномен природы - несомненно один из важнейших
для природы и человеческой практики физико-химических процессов. Греческий миф о
Пр ...
Расчет и подбор выпарной установки
...
Дериватография
Комплексный метод
исследования химических и физико-химических процессов, происходящих в образце в
условиях программированного изменения температуры. Основан на сочетании
дифференциального термическ ...


