Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Уравнение ТафтаОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Уравнение Тафта Уравнение Тафта
В 1950-х годах было предложено уравнение, аналогичное уравнению Гаммета, но применимое для чисто алифатических соединений, которые не являются производными бензола. Используя выводы Ингольда, сделанные еще в 1930 году, Тафт сравнил переходные состояния для кислотного и основного гидролиза сложных эфиров алифатических карбоновых кислот (см. разд. 18.8.2, гл. 18):
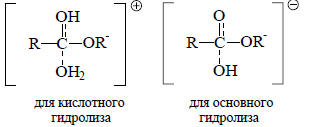
Было постулировано, что, во-первых, в этих двух реакциях пространственные взаимодействия одинаковы, поскольку переходные состояния отличаются лишь тем, что в первом из них на два протона больше, чем во втором (это не совсем верно, так как сольватация этих переходных состояний может быть очень разной). Второе предположение состояло в том, что в чисто алифатических соединениях эаместители не проявляют мезомерные (±М)-эффекты. Если принять эти два допущения, то можно сделать вывод, что различие во влиянии заместителей на скорость гидролиза сложных эфиров при кислотном и основном катализе обусловлено только полярным (т.е. индуктивным) эффектом, который должен оказывать противоположное влияние на противоположно заряженные переходные состояния. Таким образом, для реакции гидролиза ZCH2COOC2H5
lg(кCH2Z/кCH3)B-lg(кCH2Z/кCH3)A=σ*CH2Z ρ*,
где кCH2Z - константы скорости гидролиза ZCH2COOC2H5; кCH3 - константы скорости гидролиза этилацетата (CH2Z=CH3; В и А соответствуют основному и кислотному катализу; σ* ("сигма со звездочкой") - константа заместителя Тафта, дающая представление о полярном эффекте CH2Z относительно стандарта, когда CH2Z равно CH3. Чтобы величины σ* получились сравнимыми с константами σ Гаммета, Тафт выбрал значение константы реакции ρ*=2,48.
В настоящее время вместо констант σ* используют константы σI, ("сигма индуктивная"), связанные с σ* простым соотношением
σI(Z)=0,45σ*(CH2Z)
Константы σI наилучшим образом отражают чистый индуктивный эффект (в отличие от констант Гаммета, особенно для пара-заместителей, которые являются суммой полярного и мезомерного эффектов). Их определяют тремя способами.
1. Из констант диссоциации 4-замещенных бицикло[2.2.2]октан-карбоновых кислот в 50%-ном водном этаноле при 25оС:
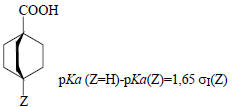
2. Из констант диссоциации замещенных уксусных кислот в воде при 25оС:
ZCH2COOH; pKa(CH3COOH)-pKa(ZCH2COOH)=3,816σI.
3. Из химических сдвигов фтора (δF) в спектрах ЯМР-19F мета-замещенных фторбензолов:
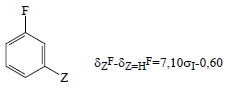
Сводка констант σI дана в табл. 3.14.
Таблица 3.13.
Индуктивные константы заместителей
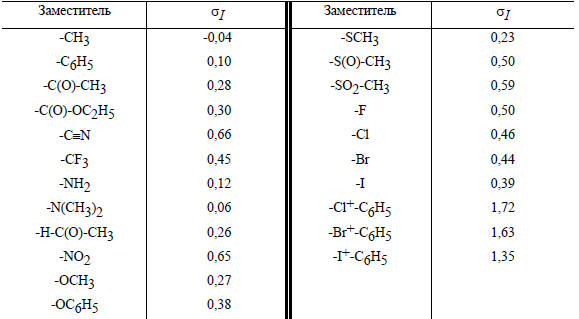
Из данных таблицы видно, что все группы, кроме алкильных, являются акцепторными, т.е. проявляют (-I)-эффект и, соответственно, имеют положительный знак σI.
Смотрите также
Реакторы идеального вытеснения
Вариант № 14
реактор газовый
поток вытеснение
В Р.И.В. Проводят
окисление SO2. Объем реакционной зоны 150 м2. Объемный расход смеси 50000 м3/г. Состав исходной смеси SO2 – 0,1; O2 – 0, ...
Флотационный метод получения хлористого калия из сильвинита
Разработка и применение различных
методов обогащения калийных и полиметаллических руд неразрывно связаны с
минеральным составом исходной руды.
Выделить ценные компоненты из руд в богатый
...


