Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Принцип стационарностиОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Принцип стационарности Принцип стационарностиСтраница 1
В большинстве случаев органические реакции не элементарны, а состоят из двух или большего числа дискретных стадий. В ходе реакций образуются интермедиаты, которые, как правило, мало устойчивы. Рассмотрим следующую двухстадийную реакцию:
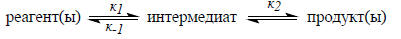
Скорость образования продуктов равна константе скорости к2, умноженной на концентрацию интермедиата. Если интермедиат нестабилен (т.е. обладает высокой энергией), то его концентрация на всех стадиях реакции будет мала, и можно допустить, что она будет постоянна. Это приближение называют принципом стационарных концентраций или принципом стационарности. Из него следует, что скорость образования интермедиата в точности равна скорости его деструкции:
к1[реагенты] = к-1[интермедиат] + к2[интермедиат].
Таким образом, скорость реакции определяется выражением
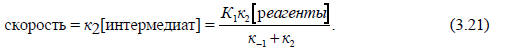
Это выражение моно представить в форме
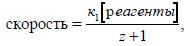
где z=к-1/к2 - фактор распределения, показывающий, в какой мере интермедиат склонен превращаться назад в реагенты, а не переходить в продукты реакции.
Если к2>>к1 (т.е. z→0), то уравнение (3.21) упрощается:
скорость = к1[реагенты].
Это означает, что каждая молекула интермедиата быстро дает продукты, и стадией, определяющей скорость всей реакции (лимитирующей стадией) является образование интермедиата (рис. 3.10,а). В такой реакции никакие события, происходящие после первой стадии, не дают кинетического эффекта. В уравнение для скорости не входят концентрации никаких частиц, участвующих в реакции мосле первой стадии, поэтому на основании кинетического анализа нельзя сказать, через сколько стадий проходит реакция после образования интермедиата. Реакция неотличима от простого одностадийного процесса, и, чтобы доказать ее сложность, нужны некинетичеаские методы. Иногда это сделать легко: например, в реакции типа
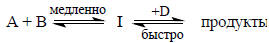
частица D входит в состав продуктов, но не входит в кинетическое уравнение.
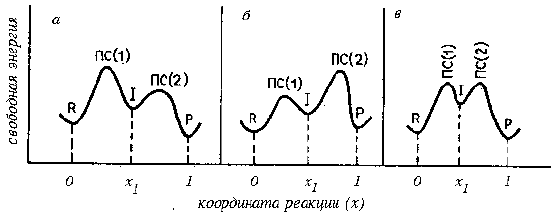
Рис. 3.10. Зависимость свободной энергии от координаты реакции (R - реагенты, I - интермедиат, P - продукты). а - k2>>k-1; б - k-1>>k2. ΔG# - свободная энергия активации лимитирующей стадии
В реакциях такого типа изменение частицы D не может влиять на скорость, и поэтому реакции с различными D (D1, D2, D3 .) идут с одинаковой скоростью. Так, катализируемое щелочами галогенирование ацетона хлором, бромом и иодом идет с одинаковой скоростью и подчиняется следующему кинетическому уравнению:
Смотрите также
Химия в быту
В моем реферате
пойдет речь о химических веществах, применяемых в быту и облегчающих домашний
труд, ведь бытовая химия - это не только стирка, уборка, но и покраска, очистка помещений, отдел ...
Насыщенные альдегиды и кетоны
Альдегиды
и кетоны относятся к карбонильным соединениям (содержат группу >С=О) Они
имеют общую формулу:
для
альдегидов R1=H.
Изомерия
кетонов связана со строением радикалов и с п ...


