Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислотность и основность в водеОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Кислотность и основность в воде Кислотность и основность в водеСтраница 2
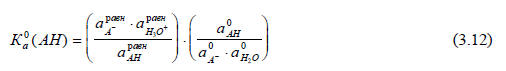
Обычно используют шкалу молярности и за стандартное состояние принимают водный раствор, в котором активность Х равна 1 моль/л при 25оС. Таким образом, в уравнении (3.12) можно сократить все размерности и член, в который входит аХ0. Далее, если рассматривать процессы только в разбавленных растворах, то можно принять, что отношение коэффициентов активности одинаково для всех кислот и близко к единице. Тогда в качестве относительной меры силы кислоты в разбавленном водном растворе при данной температуре можно использовать константу кислотности Ка(АН), которая определяется выражением

где в квадратных скобках дана молярная концентрация частиц в состоянии равновесия при фиксированной температуре (обычно 25оС). Конечно, Ка(АН) будет зависеть от концентрации АН, поскольку коэффициент активности связан с концентрацией, но, если нужно, термодинамический параметр 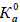 (АН) можно получить экстраполяцией к бесконечному разбавлению.
(АН) можно получить экстраполяцией к бесконечному разбавлению.
Чем больше Ка(АН), тем выше степень диссоциации (уравнение (3.10)) и тем сильнее кислота. Для характеристики кислотности удобно использовать отрицательный логарифм константы кислотности рКа(АН) или просто :рКа

Очевидно, чем больше рКа, тем слабее кислота.
Из уравнений (3.12), (3.13) и (3.14) получаем

откуда следует что величина рКа равна тому значению рН раствора, при котором кислота ионизирована наполовину.
Для воды из уравнения (3.13) получаем
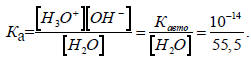
Таким образом, рКа(Н2О) = 15,7 при 25оС. Эта величина характеризует кислотность молекул воды в водном растворе. Для гидроксониевого иона рКа(Н3О+) = рКавто- pKa = 14-15,7 = -1,7.
Определение констант кислотности АН в воде с помощью прямого измерения концентраций А- и АН возможно лишь в том случае, если кислотная диссоциация происходит в заметной, но не полной степени. Если кислота так слаба, что почти не диссоциирует, или так сильна, что диссоциирует фактически нацело, то в первом случае нельзя точно измерить [A-], а во втором [AH]. Для таких кислот используются косвенные методы определения кислотности (разд. 3.3.4). В табл. 3.2 приведены величины рКа для некоторых кислот. Для кислот с рКа<0 или рКа>20 данные таблицы не очень точны. Однако некоторые значения определены с высокой степенью точности и экстраполированы к бесконечному разбавлению и поэтому представляют собой термодинамические величины рКао(НА) (уравнение (3.12)).
Соответствующее выражение для константы ионизации основания в воде можно получить аналогичным образом из уравнения
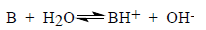
Смотрите также
Автоматизация процесса прокалки кокса
Прокаленный кокс используется для изготовления
электродов, применяемых в электролизерах для электролиза алюминия. Кокс
прокаливается с целью удаления влаги и летучих компонентов для улучшени ...
Железо в почвах. Методы определения железа
Железо — элемент, абсолютно необходимый для жизни растений,
без железа не образуется хлорофилла. В почвах железо встречается в составе
минералов группы ферросиликатов, в виде гидроокислов, о ...


