Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислотность и основность в водеОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Кислотность и основность в воде Кислотность и основность в водеСтраница 1
Если воду подвергнуть многократной перегонке в кварцевой или платиновой посуде, то оказывается, что, несмотря на такую тщательную очистку, вода все же сохраняет небольшую, но вполне определенную способность проводить электрический ток. Это обусловлено самоионизацией воды:

Константа равновесия (3.8) при строгой термодинамической записи имеет вид

где - относительная активность частицы Х в равновесной смеси; а- абсолютная активность Х в равновесной смеси и aXотн = aXравн/aX0ХавнраХ0 - абсолютная активность Х в термодинамическом состоянии системы, принятом за стандартное.
Поскольку степень протекания реакции (3.8) очень мала, относительная активность самой воды при равновесии будет очень мало отличаться от единицы (аНОотн21≈), если в качестве стандартного состояния взять гипотетическую чистую неионизированную воду. Кроме того, поскольку равновесие реакции (3.8) очень сильно сдвинуто влево, коэффициенты активность ионов Н3О+ и ОН- в чистой воде будут также близки к единице. Поэтому относительные активность Н3О+ и ОН- фактически равны их молярным концентрациям (если используется молярная шкала и в качестве стандартного состояния выбрана активность 1 моль/л). Отсюда
![где [H3O+] и [OH-] - молярные концентрации; Кавто - константа автопротолиза](images/books/295/index.25.gif) =[H3O+][OH-], Ка0
=[H3O+][OH-], Ка0
где [H3O+] и [OH-] - молярные концентрации; Кавто - константа автопротолиза воды, равная 1,00.10-14 моль2/л2 при 25оС.
Уравнение (3.8) показывает, что в чистой воде [H3O+] = [OH-], поэтому
[H3O+] = [OH-] = 1014− = 10-7 при 25оС.
Для удобства концентрацию гидроксониевых ионов целесообразно приводить в виде отрицательного логарифма, который обозначается символом рН:
рН = -lg[H3O+]
Для чистой воды рН = 7,00, в кислых растворах [H3O+]>[OH-] и рН<7, а в щелочных [H3O+]<[OH-] и рН>7.
Если [H3O+] или [OH-] нельзя считать очень малыми, то молярные концентрации уже не равны активностям, и нужно учитывать активность конкретного вида ионов.
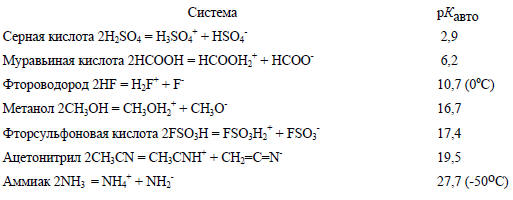
Ниже для сравнения приведены константы автопротолиза некоторых других жидкостей (рКавто = -lg[Кавто] ) при 25оС.
Диссоциацию кислоты АН в воде можно представить уравнением:

В полном виде термодинамическая константа равновесия этой реакции выражается соотношением (ср. (3.9):
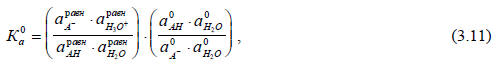
где 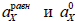 - абсолютные активности частиц Х (Х=А-, Н3О+, АН, Н2О) в равновесной смеси и в стандартном состоянии соответственно.
- абсолютные активности частиц Х (Х=А-, Н3О+, АН, Н2О) в равновесной смеси и в стандартном состоянии соответственно.
Относительная активность воды при состоянии равновесия (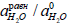 ) не сильно изменяется при переходе от одной кислоты у другой (для разбавленных растворов) и при бесконечном разбавлении приближается к единице. Поэтому можно ввести так называемую термодинамическую константу кислотности К(АН):
) не сильно изменяется при переходе от одной кислоты у другой (для разбавленных растворов) и при бесконечном разбавлении приближается к единице. Поэтому можно ввести так называемую термодинамическую константу кислотности К(АН):
Смотрите также
Методы выделения и анализа кумаринов в лекарственное растительное сырьё
Физиологическая роль кумаринов до конца не установлена. Известно, что они
участвуют в регуляции роста растений, являясь антагонистами ауксинов; поглощают
ультрафиолетовые лучи, защищая молод ...
Разработка энергосберегающей технологии ректификации циклических углеводородов
Процесс ректификации
играет ведущую роль среди процессов разделения промышленных смесей. Большая
энергоемкость процесса делает поиск оптимальных схем разделения актуальной
задачей химическо ...
Получение хлористого винила
Тема реферата «Получение хлористого винила» по дисциплине
«Органический синтез».
Хлористый винил СН2=СНС1—бесцветный газ с эфирным
запахом, температура кипения — 12,5°С, температура плавл ...


