Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислоты и основания Бренстеда. Сила кислот и основанийОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Кислоты и основания Бренстеда. Сила кислот и оснований Кислоты и основания Бренстеда. Сила кислот и оснований
Способность кислот и оснований Льюиса взаимодействовать друг с другом определяется их абсолютной "жесткостью" и абсолютной электроотрицательностью. Понятия "сильная кислота Льюиса" или "слабая кислота Льюиса" мало характеристичны, поскольку "сила кислоты" зависит от типа основания-партнера, а "сила основания" связана с типом взаимодействующей с ним кислоты.
С другой стороны, для характеристики кислот и оснований Бренстеда широко используются термины "сильный" и "слабый". Если равновесие (3.1) полностью сдвинуто вправо, то можно сделать вывод, что основание В сильнее основания А- или, по-другому, кислота ВН+ слабее кислоты АН. Сила бренстедовских кислот и оснований зависит от среды, т.е. от растворителя. Это связано с тем, что молекулы растворителя сами являются основаниями или кислотами Бренстеда. Например, если растворить кислоту АН или основание В в воде, то в растворе как кислота, так и основание будут в определенной степени ионизированы:
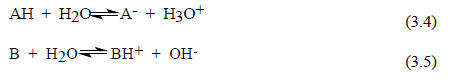
Степень ионизации характеризует силу кислоты или основания в водном растворе. В разбавленных водных растворах HCl диссоциирует полностью. Поэтому если постепенно добавлять в водный раствор HCl крепкий раствор NaOH (чтобы объем при добавлении практически не менялся) и по мере добавления измерять электропроводность нейтрализуемого раствора, то будет наблюдаться картина, описываемая кривой 1 на рис. 3.4.
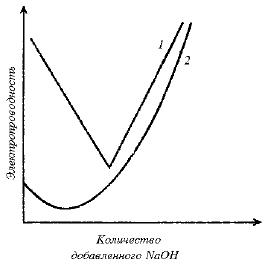
Рис. 3.4. Зависимость электропроводности раствора сильной (1) и слабой (2) кислоты от количества добавленного основания. (Кривые кондуктометрического титрования).
В первом приближении электропроводность пропорциональна числу ионов в растворе и особому характеризующему их параметру, который называется подвижностью иона. Сольватированный протон и гидроксильный ион как ионы небольших размеров имеют очень высокую подвижность, поэтому нейтрализация сильного электролита HCl приводит к связыванию сильно подвижных ионов и замене их менее подвижными частицами. В ходе нейтрализации ионы водорода заменяются значительно менее подвижными ионами натрия (HCl→NaCl), и электропроводность уменьшается. Увеличение электропроводности после точки эквивалентности обусловлено накоплением подвижных ионов ОН- из избыточного количества NаОН.
Иная ситуация наблюдается при нейтрализации уксусной кислоты (рис. 3.4, кривая 2). Уменьшение электропроводности при добавлении первых порций щелочи соответствует нейтрализации атомов водорода, которые имеются в исходном растворе вследствие равновесия ионизации (3.4). Однако в исходном растворе кислоты ионов водорода мало. После того как они израсходованы по реакции (3.6), электропроводность начинает снова возрастать, так как недиссоциированные молекулы кислоты превращаются в ацетатные ионы, - реакция (3.7):
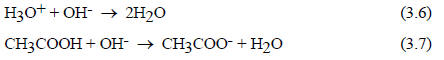
Таким образом, в водных растворах сильных кислот (HCl) истинным носителем кислотных свойств является протон (точнее ионы Н3О+, Н5О2+, Н9О4+ и т.д.), а в растворах слабых кислот (СН3СООН) - как Н3О+, так и недиссоциированная молекула кислоты. Аналогично в водных растворах сильных оснований единственно присутствующим основанием будет гидратированный ион ОН- (уравнение (3.5)), а в растворах слабых оснований - как ион ОН-, так и молекула В. Понимание такого различия необходимо при рассмотрении кислотного и основного катализа, например, в реакциях карбонильных соединений (см. разд. 3.3.6).
Смотрите также
Математическое моделирование полимерных синтетических дисперсий медицинского назначения
...
Образование сложных эфиров. Некоторые производные углеводов
В
живой природе широко распространены вещества, многим из которых соответствует
формула Сх(Н2О)у. Они представляют собой,
таким образом, как бы гидраты углерода, что и обусловило их названи ...
Заключение
Целью
проведенного исследования являлось комплексное спектроскопическое исследование
каменной соли Соликамского и Польского месторождений и разработка модели
природного синего окрашивания.
Крист ...


