Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Спектры оптического поглощения и центры окраски в природном
галитеБиблиотека / Оптическая спектроскопия кристаллов галита с природной синей окраской / Экспериментальные
результаты / Библиотека / Оптическая спектроскопия кристаллов галита с природной синей окраской / Экспериментальные
результаты / Спектры оптического поглощения и центры окраски в природном
галите Спектры оптического поглощения и центры окраски в природном
галитеСтраница 2
Таким образом, уровни энергии и волновые функции можно легко получить с помощью их значений для атома водорода. Постоянная Ридберга (R) уменьшается в e¥-2 раз, а боровский радиус увеличивается в e¥ раз. Доминирующим оптическим переходом будет аналог перехода 2S®2P обладающий энергией DЕ @ 3/4e¥-2 Ry, где Ry=Rch=13,6 эВ. Оценим энергию перехода F-центра, оптическая диэлектрическая проницаемость для NaCl e¥ =2,34 [22]: DЕ @ 3/4*(2,34)2*13,6@2,5эВ. Определенное нами значение энергии перехода в F-центрах составляет около 2,8эВ. Отсюда следует, что даже такая простая модель F-центра хорошо описывает наблюдаемое оптическое поглощение.
М-центр образован двумя электронами, захваченными на смежных анионных вакансиях. Он может рассматриваться как два смежных F-центра и как таковой является простейшим из F-агрегатных центров. Осью М-центра в галогенидах щелочных металлов является направление (110).
R-центр состоит из трех соседних F-центров в кристалле галогенида щелочного металла. F-центры расположены в вершинах равностороннего треугольника; дефект имеет ось [111].
Vk-центр - автолокализованная дырка. Он не является дефектом в обычном смысле: это не вакансия, не примесь внедрения и не какая-либо другая примесь. Это просто отсутствие электрона в валентной зоне, вызывающая значительное локальное искажение решетки. Искажение уменьшает подвижность дырки, создавая возможность наблюдать ее оптически как и в случае обычного дефекта. По своим характеристикам этот дефект близок к молекулярному иону Cl2-.
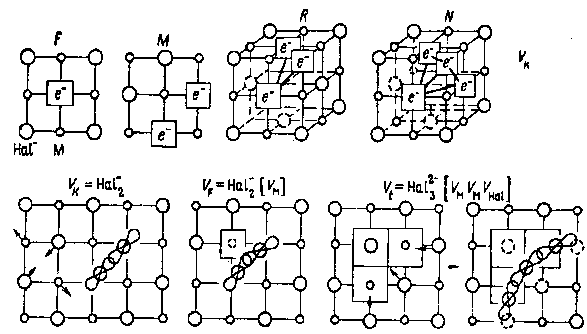
Рис.7.
Схематическое изображение центров в щелочногалоидных кристаллах.
Из разложения на отдельные Лоренцевы составляющие были определены положения, значения, ширина полос максимумов оптического поглощения с учетом данной интерпретации полос поглощения (таблица 1 Приложения). Для выяснения типа синей окраски галита проведено сравнение площадей под кривой поглощения коллоидных частиц и суммарной площади полос поглощения F-агрегатных центров. Полученные значения приведены в таблице3.
Таблица 3
Сопоставление вкладов коллоидных частиц и F-агрегатных центров в окраску синих галитов.
|
Образец |
Суммарное поглощение F-агрегатных центров, у.е. |
Поглощение колл. частиц, у.е. |
|
Соликамск1 |
0.143 |
0.142 |
|
Соликамск2 |
0.170 |
0.206 |
|
Соликамск3 |
0.081 |
0.111 |
|
Соликамск4т |
0.681 |
0.583 |
|
Соликамск4с |
0.113 |
0.205 |
|
Польша |
0.955 |
0.828 |
Исходя из этих данных окрашивание в исследуемых образцах происходит как за счет центров, так и коллоидных частиц. Незначительное преобладание F-агрегатных центров характерно для образцов Соликамск4т и Польском. В образце Соликамск1 вклады тех и других окрашивающих центров равные, в остальных образцах преобладает поглощение на коллоидных частицах.
Оценить размер коллоидных частиц в образцах помогут расчеты Савостьяновой [11], основанной на теории Ми поглощения и рассеяния света небольшими металлическими шариками. Согласно Ми, для очень малых по сравнению с длиной волны света, коэффициент поглощения k определяется по формуле:
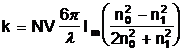 (3.6)
(3.6)
|
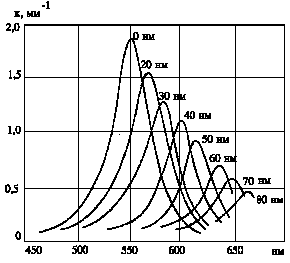
Рис.8. Кривые поглощения системы Na - NaCl для объемной доли натрия по отношению к хлористому натрию равной 10-6 (по Савостьяновой) |
где N - число коллоидных частиц в единице объема, V - объем одной частицы, l - длина волны в растворителе, n0 - показатель преломления растворителя, n1 - комплексный показатель преломления металла. Символ Im обозначает, что в скобках берется мнимая часть комплексного выражения. Савостьянова применила теорию Ми к случаю коллоидного натрия в каменной соли и получила кривые для поглощения и рассеяния (рис.8).
|
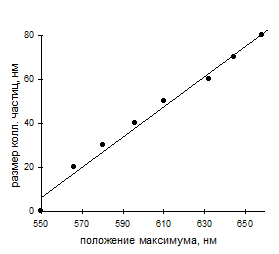
Рис.9. Зависимость положения максимума поглощения коллоидных частиц от их размера. |
Смотрите также
Исследование паровоздушной газификации низкосортных углей Украины
В
общей части дипломной работы был проведен литературный анализ методов газификации
угля, выбор о обоснование принципиальной технологической схемы получения
генераторного газа методом пар ...
Развитие хроматографии
С необходимостью
разделения и анализа смеси веществ приходится сталкиваться не только химику, но
и многим другим специалистам.
В мощном арсенале
химических и физико-химических методов ра ...
Антибиотики
Антибиотики, вырабатываемые микроорганизмами химические вещества, которые способны тормозить рост и вызывать гибель бактерий и других микробов. Противомикробное действие антибиотиков имеет избирательн ...