Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Плоский метанОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Плоский метан Плоский метанСтраница 1
Современные компьютеры и разработанные алгоритмы позволяют рассчитывать энергию молекул, которые реально не существуют (например, тетралитийметан CLi4) или существуют в природе совсем в иной геометрической конфигурации, чем конфигурация, задаваемая машине. Эта очень интересная, интенсивно развивающаяся область называется компьютерной или машинной химией, и пока расчеты ограничиваются лишь относительно небольшим молекулами. В данном разделе мы рассмотрим следующие теоретически важные вопросы. Почему природный метан имеет форму тетраэдра, а не форму, скажем, плоского квадрата? Для каких производных метана можно предсказать плоскую квадратную форму? Какие подобные метану соединения АН4, где А - элемент IV группы, способны существовать в плоской форме?
Молекулярные орбитали плоского метана можно построить из орбиталей углерода и групповых орбиталей плоского квадратного ансамбля Н4. Последние должны иметь элементы симметрии D4h (квадрата). Поскольку орбитали ансамбля образуются из четырех Н1s-орбиталей, их общее число должно быть равно четырем. Как и для тетраэдрического ансамбля Н4 (см. рис. 2.18), МО плоского Н4 со «связями», направленными к центру квадрата, начинаем строить путем возмущения связывающих и антисвязывающих σ и σ*-орбиталей молекул Н2 (рис. 2.26).
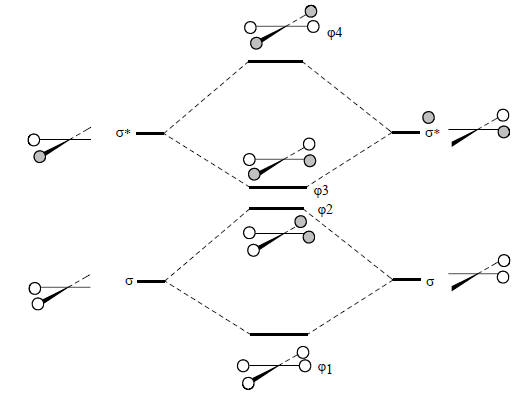 Рис. 2.26. Диаграмма орбиталей для квадратной молекулы Н4
Рис. 2.26. Диаграмма орбиталей для квадратной молекулы Н4
Затем растягиваем квадрат, удлиняя расстояния Н-Н; тогда связывание и антисвязывание уменьшаются и все четыре орбитали ансамбля Н4 имеют примерно равные энергии, близкие к энергии вырожденных орбиталей ϕ2 и ϕ3 на рис. 2.26.Орбитали ϕ3 и ϕ4 имеют по одному узлу и полностью совмещаются друг с другом при повороте одной из них на 90о. Как и соответствующие орбитали тетраэдрического ансамбля, их можно представить и в иной эквивалентной форме с узловыми плоскостями, проходящими не через середины противоположных сторон, а через вершины квадрата:
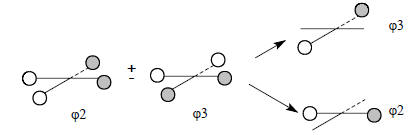
Оба представления совершенно идентичны, но симметрия орбиталей, представленных справа, хорошо адаптирована к симметрии орбиталей С2рх и С2ру. Поэтому при построении орбитальной диаграммы плоского метана мы будем использовать второе представление.
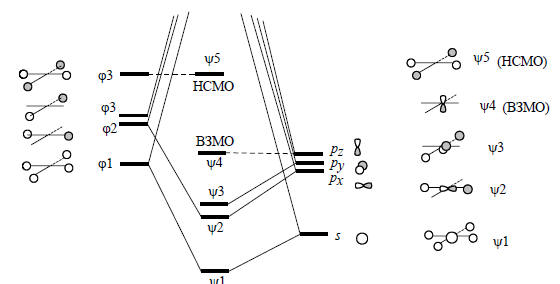 Рис. 2.27. Диаграмма орбитального взаимодействия для молекулы плоского метана
Рис. 2.27. Диаграмма орбитального взаимодействия для молекулы плоского метана
На рис. 2.27. изображены пять из восьми валентных орбиталей плоского метана. Картина получается чрезвычайно интересная. В молекуле СН4 связывание может осуществляться восемью валентными электронами. В тетраэдрическом метане все эти электроны участвуют в образовании СН-связей: на каждую связь по два электрона. Однако в плоском метане в образовании СН-связей участвуют только шесть электронов. Эти заполненные орбитали обозначены как ψ1, ψ2 и ψ3 (орбитали ψ2 и ψ3 вырождены).Оставшиеся два электрона находятся на несвязывающей р-орбитали ψ4 (рz), перпендикулярной плоскости молекулы. Таким образом, ВЗМО плоского метана (ψ4) имеет характер неподеленной пары. НСМО плоского метана (ψ5) - это групповая орбиталь ϕ4. Она имеет две узловые плоскости. У атома углерода нет низко лежащих орбиталей с двумя узловыми плоскостями (3d-орбитали расположены слишком высоко) , поэтому уровень ϕ4 не может расщепиться на связывающий и антисвязывающий.Неэмпирические расчеты показывают, что энергия плоского метана на 141 ккал/моль выше энергии тетраэдрического метана (Шлайер, 1985), что значительно превышает энергию диссоциации связи С-Н (104 ккал/моль). Следовательно, тетраэдрический природный метан скорее продиссоциирует с отрывом атома водорода, чем перейдет в плоскую форму. Это означает, что асимметрические соединения с хиральным центром на атоме углерода не могут изменить свою конфигурацию без разрыва химических связей, что обусловливает высокую стабильность оптически активных соединений углерода, которые не могут самопроизвольно рацемизоваться, проходя через конфигурацию плоского квадрата:
Смотрите также
Катионы второй аналитической группы
...
Бензимидазол, его производные, их свойства и синтез трихлорбензимидазола
...
Получение хлора и щелочи путем электролиза водных растворов хлоридов щелочных металлов. Извлечение ртути
Электролизеры для производства хлора и щелочи, в
которых используется ртутная амальгама, находят широкое применение благодаря
возможности получения концентрированных растворов щелочи. Однако ...


