Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Плоский метанОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Плоский метан Плоский метанСтраница 2
С помощью обычных структурных формул однозначно изобразить строение плоского метана довольно сложно. Вероятно, лучше всего рассматривать плоскую молекулу СН4 как плоский метильный карбанион СН3-, протонированный не по р-орбитали углерода, несущей отрицательный заряд, а по σ-связи С-Н:

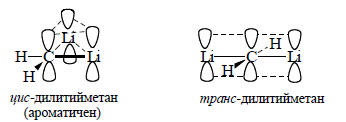
Эта цвиттерионная и к тому же неклассическая структура, естественно, должна быть очень нестабильной.Плоский метан должен стабилизироваться, если вместо водорода ввести π-акцепторные (-М) или σ-донорные (+I) заместители. Первые будут уменьшать дефицит электронов σ-остова молекулы. Особенно эффективно введение атомов лития, обладающего сильными (-М) и (+I)-эффектами.Показательно влияние двух атомов лития. Согласно расчетам, разница в энергиях между цис-планарным и тетраэдрическим дилитийметаном составляет всего 5 ккал/моль (в пользу последнего). Транс-дилитийметан на 17 ккал/моль менее стабилен, чем цис-изомер. Это связано с тем, что в цис-дилитийметане возможна Хюккелевская 2π-электронная ароматичность (см. гл. 12), так как неподеленная пара плоского метана способна к делокализации на пустых р-орбиталях атомов лития:
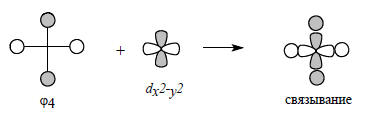
Как отмечалось выше, плоский метан нестабилен потому, что групповая орбиталь ϕ4 не участвует в связывании. Если бы эта орбиталь сильно возмущалась, то нижний возмущенный уровень мог бы уйти ниже уровня орбитали рz, и тогда в связывании четырех атомов водорода участвовало бы уже не 6, а 8 электронов. Это возможно в аналогах метана АН4, в которых центральный атом А имеет доступные (т.е. относительно низко лежащие) d-орбитали, так как симметрия d-орбиталей (два угловых узла) как раз подходит к симметрии орбитали ϕ4.
Действительно, неэмпирический расчет показывает, что в ряду СН4, SiH4, GeH4, SnH4, TiH4 энергия плоских форм молекул постепенно и значительно понижается, поскольку 3d-орбитали становятся все более и более доступными (по энергии) для эффективного взаимодействия с ϕ4. В молекуле TiH4 d-орбитали титана очень эффективно связывают атомы водорода и рассчитанные энергии плоской квадратной и тетраэдрической форм мало отличаются между собой.Вторым важным фактором является увеличение размеров центрального атома. Чем больше атомный радиус, тем дальше отстоят друг от друга атомы водорода, т.е. тем больше размеры групповой орбитали Н4. Это понижает энергию орбитали ϕ4, так как в ней все взаимодействия между соседними атомами водорода антисвязывающие. Эффект заметен в случае плоского силана SiH4, в котором пустые d-орбитали кремния еще лежат достаточно высоко и эффективно не участвуют в связывании, но порядок расположения орбиталей иной, чем у плоского метана. В плоском SiH4 высшей занятой является орбиталь ϕ4, а низшей свободной - орбиталь pz, тогда как в плоском метане, наоборот, роль ВЗМО играет pz, а роль НСМО - орбиталь ϕ4.Заметим, что все известные в настоящее время тетракоординированные соединения элементов группы IVa, т.е. кремния, германия, олова и свинца, а также элементов группы IVб, т.е. титана, циркония и гафния, все-таки имеют тетраэдрическое строение.


