Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
π-Системы, содержащие гетероатомОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / π-Системы, содержащие гетероатом π-Системы, содержащие гетероатомСтраница 2
Таблица 2.7 Вклады атомов в МО енолят-иона ацетальдегида

Мы видим, что по всем орбиталям (в строках) и по всем атомам (в столбцах) коэффициенты меняются таким образом, что определения «большой», «средний» и «небольшой» встречаются по одному разу, и нет ни одной орбитали и ни одного атома, для которых все коэффициенты (или даже два из трех) были бы большими, средними или небольшими. Это является следствием принципа квантования, согласно которому приемлемыми решениями уравнения Шредингера являются нормализованные орбитали (разд. 1.3, гл. 1), и может
служить руководящим принципом при составлении качественных картин молекулярных орбиталей.Узловые свойства π-орбиталей енолят-аниона в принципе такие же, как и для аллильного аниона (ср. рис. 2.6 и 2.14): нижняя орбиталь не имеет узлов, вторая орбиталь имеет один узел, а третья - два узла. Однако узлы в енолят-анионе расположены несимметрично: например, узловая плоскость орбитали ψ2 не проходит через центральный атом, а находится где-то между атомами С1 и О. Тем не менее сохраняется топологическое подобие орбиталей аллила и енолята и этого, как мы увидим далее (гл. 17), бывает вполне достаточно, чтобы утверждать, что аллильный и енолятный анионы должны проявлять качественно сходные химические свойства.Акролеин (бутеналь) СН2=СН-СН=О представляет собой четырехатомную π-систему с гетероатомом. Молекулярные π-орбитали этого альдегида показаны на рис. 2.15.На примере этого альдегида можно показать, что качественную картину распределения коэффициентов при разных атомах в разных орбиталях можно дать, не прибегая к расчетам, а пользуясь лишь простой логикой. Прежде всего следует найти чисто углеродный аналог акролеина; это бутадиен, орбитали которого приведены на рис. 2.8. π-Система актролеина по узловым свойствам должна быть подобна π-системе бутадиена, поэтому орбитали акролеина строим так, чтобы нижняя орбиталь не имела узлов и была «симметричной» относительно центральной плоскости.
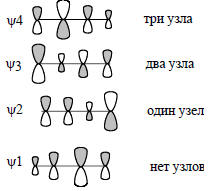 Рис. 2.15. π-Орбитали акролеина. В районе орбитали ψ2 находятся несвязывающие орбитали неподеленных пар электронов атома кислорода. Одна из этих орбиталей по энергии такая же, как ψ2, а другая лежит на 40 ккал /моль выше ψ2. НСМО - это орбиталь ψ3, но ВЗМО - это не орбиталь ψ2, а выше лежащая орбиталь неподеленной пары.
Рис. 2.15. π-Орбитали акролеина. В районе орбитали ψ2 находятся несвязывающие орбитали неподеленных пар электронов атома кислорода. Одна из этих орбиталей по энергии такая же, как ψ2, а другая лежит на 40 ккал /моль выше ψ2. НСМО - это орбиталь ψ3, но ВЗМО - это не орбиталь ψ2, а выше лежащая орбиталь неподеленной пары.
Симметрию при этом нужно понимать не в абсолютном смысле. Строго говоря, орбиталь ψ1 акролеина несимметрична (в отличие от бутадиена), поскольку атомные коэффициенты распределены несимметрично; о симметрии можно говорить только в топологическом смысле. Орбиталь ψ2 должна быть «антисимметрична» и иметь один узел в центре молекулы, орбиталь ψ3 «симметрична» и имеет два узла, и, наконец, орбиталь ψ3 «антисимметрична» и имеет три узла (между каждой парой соседних АО, как и бутадиен).Теперь обсудим, каковы должны быть коэффициенты, т.е. относительные размеры атомных орбиталей на рис. 2.15. Начнем с орбитали ψ2. Она имеет узел между С(1) и С(2), т.е. между этиленовым фрагментом и карбонильным фрагментом нет связывания. Следовательно, приближенно эту орбиталь можно представить как изолированную связывающую π-орбиталь этилена (см. рис. 2.5) и изолированную связывающую π-орбиталь карбонильной группы (см. рис. 2.13). Этиленовая π-орбиталь имеет равные вклады от обоих атомов, а π-орбиталь карбонила - значительно больший вклад от кислорода, чем от углерода. Таким образом, можно полагать, что в орбиталь ψ2 акролеина атомы С(3) и С(2) будут вносить «средний» вклад, атом С(1) - «небольшой», атом О - «большой» (рис. 2.15). Вообще говоря, трех определений («большой», «средний» и «небольшой») для четырехатомной системы недостаточно: нужно четыре градации, так как вклад от каждого из четырех атомов может быть разным, однако для простоты мы будем использовать лишь эти три термина. Орбиталь ψ4 можно рассматривать как антисвязывающую комбинацию разрыхляющей π*-орбитали аллильного фрагмента и р-орбитали атома кислорода, поэтому она должна быть похожа, с одной стороны, на изолированную π*-орбиталь аллила (см. рис. 2.6). С другой стороны, эта орбиталь будет похожа и на орбиталь формальдегида (рис. 2.13). π*-Орбиталь аллила имеет больший вклад от С(2), а π*-орбиталь С=О имеет больший вклад от С, чем от О. Поэтому в акролеине коэффициенты на С(3) и С(1) можно взять «средними», коэффициент на С(2) - «большим», а на О - «небольшим». Орбиталь ψ1 связывает все четыре атома, и является связывающей комбинацией π-С=С и π-С=О. В бутадиене аналогичная орбиталь имеет увеличенный вклад от средних атомов (см. рис. 2.8). Поэтому коэффициент при атоме С(1) будет больше, чем в связывающей орбитали изолированной карбонильной группы. Из-за этого немного уменьшится коэффициент при О. Коэффициент при С(2)
Смотрите также
Самоорганизация полимеров
Известно, что многие макромолекулы, содержащие атомные группы
различной химической природы, способны самопроизвольно образовывать сложные
трёхмерные ансамбли. Это явление называется самоорга ...
Основные принципы подбора условий разделения
Перед
начинающим хроматографистом проблема выбора типа разделительной системы
(эксклюзионной, ион-парной, адсорбционной или другой) и подбора условий, с
которыми лучше эту систему использов ...
Термоэластопласты, фторкаучуки, полисульфон
Значение
полимеров и материалов на их основе их композиций в современной технике и
народном хозяйстве очень велико. Сложно представить хотя бы одну область
человеческой жизнедеятельности, г ...


