Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Понятие об активной кислотности.Библиотека / Определение содержания аскорбиновой кислоты в яблоках различных сортов / Библиотека / Определение содержания аскорбиновой кислоты в яблоках различных сортов / Понятие об активной кислотности. Понятие об активной кислотности.
Вода и водные растворы диссоциирующих веществ в той или иной степени ионизированы. В воде непрерывно протекает процесс диссоциации воды на водородный и гидроксильный ионы и рекомбинация этих ионов в недиссоциированные молекулы воды. Скорость распада воды на ионы пропорциональна действующей массе реагирующих молекул воды, а скорость рекомбинации воды пропорциональна произведению действующих масс реагирующих ионов. Это состояние выражается формулой
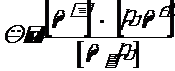 ,
,
где К – константа диссоциации, а символы в квадратных скобках – концентрации соответствующих ионов и молекул.
Кислоты в водных растворах диссоциируют на водородный ион и отрицательно заряжнный остаток кислоты. Сильные кислоты почти нацело диссоциированы на ионы, а слабый – диссоциированы в слабой степени. Наприме, 0.1 н. раствора HCl диссоциирован на 91 %, а такой же раствор уксусной кислоты только на 1.36%. Следовательно, сила кислот зависит не от общего количества находящегося в них водорода, а только от ионов водорода. От концентрации водородных ионов зависит истинная кислотность или щелочность среды.
В настоящее время принято обозначать концентрацию водородных ионов символом рН для растворов не крепче нормального. Численное выражение рН представляет собой десятичный логарифм числа, показывающего количество граммов водородных ионов в 1л. При этом отрицательный знак опущен.
Смотрите также
Обзор источников образования тяжелых металлов
Тяжелые
металлы применяются во многих отраслях промышленности, таких как металлургия,
химическая технология, электрохимия, резиновая, текстильная, фарфоровая и
другие. В производственных пр ...
Неорганические аниообменники, синтезированные на основе гидроксидов металлов
В представленных
статьях гидроксиды металлов рассмотрены в качестве ионитов в различных водных и
смешанных средах. Обсуждены химические и физические свойства, методы синтеза и
сорбционная а ...
Производство этилового спирта
Этиловый спирт находит широкое применение в народном хозяйстве в
качестве растворителя, также применяется в производстве дивинила, в пищевой и
медицинской промышленности, в качестве горючего ...


