Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Статические и динамические электронные эффектыОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Статические и динамические электронные эффекты Статические и динамические электронные эффектыСтраница 1
Индуктивный и мезомерный эффекты, определяемые из дипольных моментов органических молекул, характеризуют распределение электронной плотности в нереагирующих молекулах. Такие эффекты носят название статических факторов распределения электронной плотности. Наличие определенных групп, обладающих этими электронными эффектами, обусловливает полярность данной молекулы, т.е. постоянный дипольный момент. Однако в ходе химической реакции, когда рассматриваемая молекула тесно сближается с молекулой второго полярного реагента, она попадает под влияние его электрического поля, и поэтому первоначальное распределение электронов нарушается. Дипольные моменты сблизившихся и определенным образом ориентированных друг по отношению к другу реагентов уже не такие, как для изолированных молекул. Изменение дипольных моментов зависит от поляризуемости реагентов. Новое распределение электронной плотности в самом начале реакции под влиянием второго реагента называется динамическим фактором.Возникает вопрос: можно ли свойства молекул в нереагирующем состоянии переносить на реагирующие молекулы? Другими словами, вся ли информация о реакционной способности заложена в свойства исходных реагентов? Этот вопрос принципиально важен, поскольку свойства стабильных реагентов можно исследовать экспериментально (например, с помощью различных видов спектроскопии), тогда как о свойствах переходного состояния можно судить лишь косвенно.Отвечая на этот вопрос, можно сказать, что многочисленные экспериментальные данные, полученные до настоящего времени, показывают, что информация о реакционной способности уже имеется в нереагирующих молекулах, однако не вся. Основной принцип, которым следует руководствоваться, состоит в следующем: если в статическом состоянии молекулы проявляется определенный электронный эффект, то в переходном состоянии реакции он может только усилиться или не проявляться вовсе, но не может изменить свой знак на противоположный. Например, анилин реагирует с электрофильными агентами, давая продукты пара- и орто-замещения:
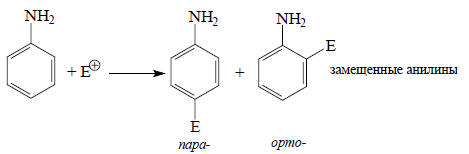
Такая ориентация наблюдается независимо от того, какой берется электрофил, и объясняется (+М)-эффектом аминогруппы (см. гл. 13). Однако при нитровании азотной кислотой образуется мета-нитроанилин. Следуя приведенному выше принципу, можно утверждать, что этого быть не должно. И действительно, мета-замещение обусловлено тем, что в азотной кислоте с электрофилом (NO2+) реагирует не сам анилин, а ион анилиния:
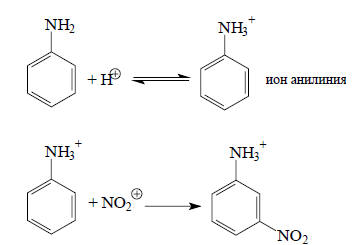
В ионе анилиния неподеленная пара электронов азота связывает протон, и мезомерный эффект ее уже не проявляется. Вместо этого действует сильный (-I)-эффект группы NH3+. Другими словами, истинным реагентом является не анилин, а ион анилиния, который по электронному распределению совершенно не похож на анилин. Таким образом, сформулированный выше качественный принцип может служить путеводной нитью при анализе возможных механизмов изучаемой реакции.
Динамический фактор зависит от конкретной реакции, например, от характера реагента в однотипных превращениях. В качестве примера рассмотрим реакцию ионизации пара-метоксибензилхлорида под действием раззных кислот Льюиса МХn (AlCl3, GaBr3, TiCl4 и т.д.):
Смотрите также
Фазовые равновесия
Гетерогенная
система - система,
состоящая из нескольких фаз.
Фазой называется
совокупность гомогенных (однородных) частей системы, одинаковых по составу,
химическим и физическим свойств ...


