Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Двухатомные молекулыОткрытая химия / Химическая связь / Открытая химия / Химическая связь / Двухатомные молекулы Двухатомные молекулыСтраница 2
1. Удаление электрона со связывающей орбитали уменьшает энергию связи в молекулярном ионе (![]() и
и ![]() ), а удаление электрона с разрыхляющей орбитали приводит к увеличению энергии связи в молекулярном ионе в сравнении с молекулой (
), а удаление электрона с разрыхляющей орбитали приводит к увеличению энергии связи в молекулярном ионе в сравнении с молекулой ( и
).
2. Потенциал ионизации молекулы () больше потенциала ионизации атома (
![]() ), если в молекуле верхний заполненный уровень – связывающий. И наоборот,
), если в молекуле верхний заполненный уровень – связывающий. И наоборот, ![]() меньше, чем
меньше, чем ![]() , если верхний заполненный уровень – разрыхляющий. Например,
, если верхний заполненный уровень – разрыхляющий. Например, = 15,58 эВ, а
= 14,53 эВ, но
= 12,08 эВ, а
= 13,62 эВ. 3. Схема МО легко объясняет наличие неспаренных электронов, а следовательно, парамагнетизм таких частиц, как молекулы
![]() и
и , и молекулярных ионов
![]() и
и
 |
|
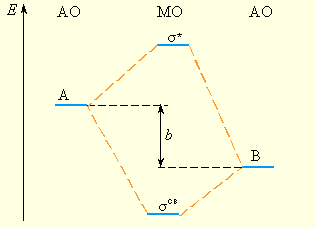
Рисунок 3.12 Энергетическая диаграмма МО гетероядерной молекулы АВ, где A имеет меньшую электроотрицательность, чем B |
В случае гетероядерных молекул в связывающие орбитали значительный вклад вносят атомы с большой электроотрицательностью (рис. 3.12), и связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома.
Величина «b» антибатна ковалентности связи. Cледует отметить, что в общем виде для гетероатомных изоэлектронных молекул можно использовать одни и те же схемы МО. Например, для рассмотрения строения СО, BF, NO+ и CN– можно использовать схему МО для N2, так как у всех этих частиц по 10 валентных электронов.
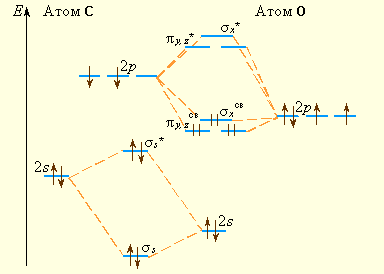
Однако в отличие от гомоядерных эти молекулы хотя и изоэлектронны, но образованы атомами с неодинаковыми зарядами атомов Z. Например, в молекуле СО АО кислорода лежат ниже АО углерода (это различие отражается на величинах потенциалов ионизации атомов: I1 углерода – 11,09 эВ, I1 кислорода – 13,62 эВ). Схема МО молекул СО, BF и молекулярных ионов NO+, CN– несколько трансформирована по сравнению с N2 в соответствии с требованиями построения диаграмм МО гетероядерных молекул. На рис. 3.13 приведена энергетическая диаграмма МО молекулы СО. При сохранении кратности связи энергия связи СО равна 1070 кДж∙моль–1 против 842 кДж∙моль–1 в N2. Это увеличение вызвано дополнительным вкладом ионной составляющей из-за разности электроотрицательностей атомов углерода и кислорода. Адекватное экспериментальным данным строение монооксида углерода соответствует формуле C– ≡ O+. Такое необычное распределение зарядов обусловлено переходом лишней по сравнению с углеродом (![]()
) электроннной пары O(
![]()
) на молекулярные орбитали СО и хорошо согласуется с экспериментальной величиной дипольного момента СО μ = –0,027∙10–29 Кл∙м (–0,08 D). Отрицательный знак означает направление дипольного момента от кислорода к углероду.
 |
|
Рисунок 3.13 Энергетическая диаграмма МО молекулы СО |
Смотрите также
Свойства титана и его соединений
Титан находится в побочной
подгруппе четвертой группы, следовательно относится к переходным элементам.
Переходные элементы обладают определенными схожими свойствами.
Общая характеристика
...
Нитрование n-нитроацетанилид
Нитрования – один
из важнейших процессов в химической промышленности. Продукты, получаемые за
счёт нитрования, являются полуфабрикатами для производства многих товаров
различных назначений ...


