Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Двухатомные молекулыОткрытая химия / Химическая связь / Открытая химия / Химическая связь / Двухатомные молекулы Двухатомные молекулыСтраница 1
У элементов второго периода в образовании химических связей принимают участие кроме s- еще и p-орбитали, при этом соблюдаются следующие условия: АО должны иметь близкие энергии, перекрываться в значительной степени, иметь одинаковую симметрию относительно линии связи, число МО должно быть равно числу образующих их АО.
Итак, рассмотрим гомоатомные молекулы второго периода.
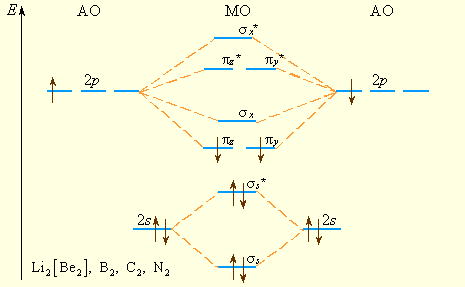
Если подуровни 2s- и 2p-состояний достаточно разделены по энергии, комбинации s- и p-АО можно рассматривать раздельно; 2s-орбитали образуют МО и
* (рис 3.10). Из рис 3.10 видно, что возможно образование молекулы
, но не
, поскольку
и
* заселены одинаково. Одна из 2p-орбиталей, например,
![]() -орбиталь, при комбинации с
-орбиталь, при комбинации с ![]() -орбиталью другого атома образует связь
-орбиталью другого атома образует связь -типа. Оставшиеся две АО
![]() и
и перпендикулярны линии связи (оси x) и энергетически равноценны. Поэтому они образуют два вырожденных уровня энергии, соответствующих МО
![]()
![]() и
и ![]() *,
*, ![]() *. В начале периода s- и p-подуровни близки по энергии, поэтому уровень
*. В начале периода s- и p-подуровни близки по энергии, поэтому уровень расположен выше
-,
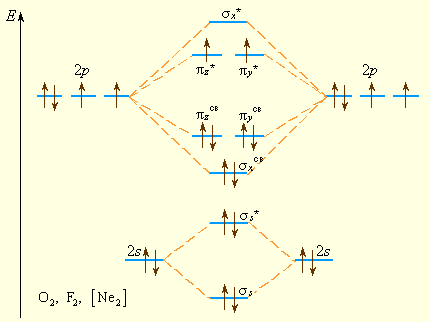
-уровней (рис. 3.10). Поскольку расстояние между s- и p-подуровнями увеличивается в периоде с ростом Z, то схема уровней на рис. 3.11 лучше всего описывает молекулы элементов конца периода, начиная с кислорода.
 |
|
Рисунок 3.10 Уровни энергии МО элементов 2 периода (начало периода). Заселение МО указано для B2 |
 |
|
Рисунок 3.11 Уровни энергии МО элементов 2 периода (конец периода). Заселение МО указано для О2 |
В табл. 3.2 приводятся схемы МО гомоядерных молекул элементов второго периода. Как видно из нее, кратность, длина и энергия связи определяются числом связывающих и разрыхляющих электронов.
Если воспользоваться рассмотренными символами, то электронную формулу молекулы кислорода можно записать так: (σs)2(σs*)2(σx)2 (πy, πz)4(πy*, πz*)2.
Анализ табл. 3.2 позволяет сделать ряд выводов.
Смотрите также
Активность. Порядок реакций
...
Сравнение изотермического реактора идеального вытеснения и реактора полного смешения в зависимости от степени превращения
Серная кислота
является одним из крупнотоннажных продуктов химической технологии. Серная кислота
относиться к числу сильных кислот и является самой дешёвой. Она реагирует почти
со всеми мет ...
Жидкофазный металлокомплексный катализ
Все реакционные системы
принято делить на гомофазные и гетерофазные. В первом случае в реакционной
системе отсутствуют границы раздела фаз. Катализатор и реагенты находятся в
одной фазе и в ...


