Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Форма молекул.Органическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Форма молекул. Форма молекул.Страница 1
sp3-Гибридизация. Молекула метана СН4 образуется из одного атома углерода и четырех атомов водорода. В основном состоянии атом углерода имеет электронную конфигурацию 1s22s22p2. С учетом правила Хунда можно утверждать, что два 2р-электрона располагаются на двух ортогональных 2р-орбиталях и имеют параллельные спины. Следовательно, в основном состоянии атом углерода может образовать только ненасыщенную частицу СН2, которая называется метиленом. Действительно, метилен известен; это короткоживущая, очень реакционноспособная частица (см.гл. 5). Чтобы из атома углерода и четырех атомов водорода получить метан, нужно сначала промотировать атом С в возбужденное состояние 1s22s2p3, в котором уже четыре электрона (один 2s и три 2р) будут неспаренными. Такое промотирование связано с переводом 2s-электрона на 2р-орбиталь, лежащую выше, и требует затраты энергии, но эта затрата затем с избытком компенсируется образованием четырех СН-связей метана [C(1s22s2p3)+4H(1s)CH4].
При гибридизации одной s -орбитали и трех р-орбиталей образуются так называемые sp3-гибридные орбитали (h1, h2, h3 и h4), которые записываются следующим образом:
h1 = 1/2 [(s+px)+(py+pz)],
h2 = 1/2 [(s+px)-(py+pz)],
h3 = 1/2 [(s-px)+(py-pz)],
h4 = 1/2 [(s-px)-(py-pz)]/
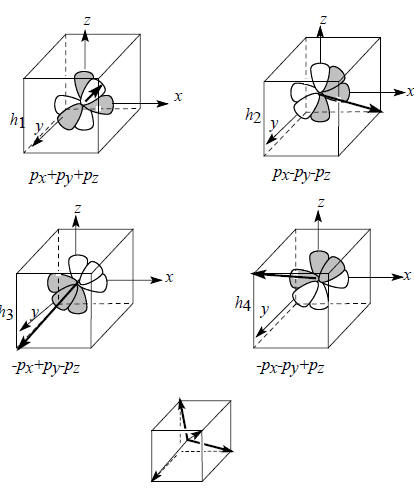
Рис.1.12. Пространственная направленность sp3-гибридных атомных орбиталей.
Чтобы определить пространственное направление sp3-гибридных орбиталей, нужно определить направление вектора, проведенного из точки пересечения трех узловых плоскостей по линии области положительной интерференции орбиталей. Эта процедура показана на рис. 1.12; здесь приведена только комбинация трех р-орбиталей, ибо именно она определяет направление гибридной орбитали, тогда как сферическая s-орбиталь может лишь увеличить амплитуду орбитали в данном направлении, но не изменить это направление. В результате получаем, что направления максимальной амплитуды волновой функции таковы, что атомы водорода должны располагаться в вершинах правильного тетраэдра. Это согласуется с тетраэдрическим строением молекулы метана и других предельных углеводородов.
Таким образом, концепция гибридизации позволяет определить, где в пространстве локализованы молекулярные орбитали, т.е. связывает классические и квантовомеханические представления о структуре соединений.
Тетраэдрическую конфигурацию можно предположить и для таких молекул, как NH3 и Н2О. Но в этих случаях один угол тетряэдра в случае NH3 и два угла тетраэдра в случае Н2О не будут заняты атомами водорода. Эти углы не будут пустыми, так как в них будут находиться неподеленные пары электронов со спаренными спинами:
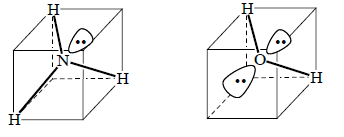
Эксперимент, однако, показывает, что угол HNH в NH3 равен 107о, а угол НОН в Н2О - 104.5о, т.е. эти углы меньше, чем должны быть в правильном тетраэдре (в метане угол НСН равен 109.5о). Это означает, что три связи NH в NH3 и две связи ОН в Н2О немного «поджаты» друг к другу. Поджатие обусловлено действием неподеленных пар, которые в отличие от электронных пар связей NH и ОН не имеют возможности «сжаться» между двумя ядрами, и поэтому, занимая большой объем пространства, взаимодействуют с электронами σ-связей, отталкивая их от себя. В молекуле Н2О, кроме того, отталкиваются друг от друга и сами электронные пары. Наличие неподеленных пар оказыает огромный эффект на пространственное строение и реакционную способность органических соединений.
sp2-Гибридизация. В молекуле этилена (этена) Н2С=СН2 двойная связь С=С состоит из одной σ-связи и одной π-связи. σ-Связь образуется боковым перекрыванием двух одинаково направленных р-орбиталей соседних атомов углерода, промотированных в состояние 1s22s2p3. Оставшиеся одна 2s-орбиталь и две 2р-орбитали дают три эквивалентные sp2-гибридные орбитали, а если орбитали эквивалентны, они должны располагаться как можно дальше одна от другой, т.е. в одной плоскости под углом 120о. Эти гибридные орбитали записываются следующим образом:
Смотрите также
Описание технологического процесса получения грунтовки водно-дисперсионной глубокого проникновения
...
Заключение
В ходе проведенной работы были рассчитаны
геометрические параметры соединений сульфаниламидного ряда и предсказана
вероятность проявления ими некоторых видов физиологической активности. Результатом
...
Постановка задачи
Целью данной работы являлась структурная и параметрическая
оптимизация технологической схемы разделения смеси
бензол-хлорбензол-дихлорбензол для снижения энергозатрат на разделение.
Для достижени ...


