Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Гидролиз солейCправочник по химии для подготовки к ЕГЭ / Водные растворы. Растворимость и диссоциация веществ. Ионный
обмен. Гидролиз солей / Cправочник по химии для подготовки к ЕГЭ / Водные растворы. Растворимость и диссоциация веществ. Ионный
обмен. Гидролиз солей / Гидролиз солей Гидролиз солейСтраница 2
![]()
Катион аммония в этом случае образует слабое основание – гидрат аммиака:
![]()
Список гидролизующихся катионов:
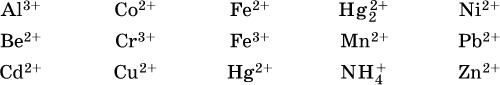
Примеры:
а)
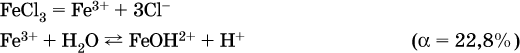
б)
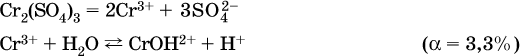
в)
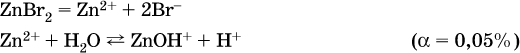
г)
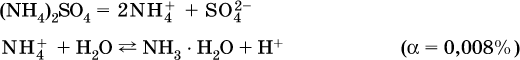
Обратите внимание, что в примерах (а – в) нельзя увеличивать число молекул воды и вместо гидроксокатионов FeOH2+, CrOH2+, ZnOH+ писать формулы гидроксидов FeO(OH), Cr(OH)3, Zn(OH)2. Если бы гидроксиды образовались, то из растворов солей FeCl3, Cr2(SO4)3 и ZnBr2 выпали бы осадки, чего не наблюдается (эти соли образуют прозрачные растворы).
Избыток катионов Н+ легко обнаружить индикатором или измерить специальными приборами. Можно также
проделать такой опыт. В концентрированный раствор сильно гидролизующейся по катиону соли, например AlCl3:
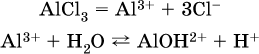
вносится магний или цинк. Последние прореагируют с Н+:
![]()
и будет наблюдаться выделение водорода. Этот опыт – дополнительное свидетельство протекания гидролиза катиона Al3+ (ведь в раствор AlCl3 мы не добавляли кислоту!).
Примеры заданий частей А, В
1. Сильный электролит – это
1) С6Н5ОН
2) СН3СООН
3) С2Н4(ОН)2
4) К(НСОО)
2. Слабый электролит – это
1) иодоводород
2) фтороводород
3) сульфат аммония
4) гидроксид бария
3. В водном растворе их каждых 100 молекул образуется 100 катионов водорода для кислоты
1) угольной
2) азотистой
3) азотной
4) серной
4–7. В уравнении диссоциации слабой кислоты по всем возможным ступеням
4. Н3РO4
5. H2SeO3
6. H4SiO4
7. HF
сумма коэффициентов равна
1) 3
2) 6
3) 9
4) 12
8–11. Для уравнений диссоциации в растворе двух щелочей набора
8. NaOH, Ва(ОН)2
9. Sr(OH)2, Са(ОН)2
10. КОН, LiOH
11. CsOH, Са(ОН)2
общая сумма коэффициентов составляет
1) 5
2) 6
3) 7
4) 8
12. В известковой воде содержится набор частиц
1) СаОН+, Са2+, ОН‑
2) Са2+, ОН‑, Н2O
3) Са2+, Н2O, О2‑
4) СаОН+, О2‑, Н+
13–16. При диссоциации одной формульной единицы соли
13. NH4NO3
14. К2Cr2O7
15. Al(NO3)3
16. Cr2(SO4)3
число образующихся ионов равно
1) 2
2) 3
3) 4
4) 5
17. Наибольшее
количество иона РО4‑3 можно обнаружить в растворе, содержащем 0,1 моль
1) NaH2PO4
2) NaHPO4
3) Н3РO4
4) Na3PO4
18. Реакция с выпадением осадка – это
1) MgSO4 + H2SO4 →…
2) AgF + HNO3 →…
3) Na2HPO4 + NaOH →…
4) Na2SiO3 + HCl →…
19. Реакция с выделением газа – это
1) NaOH + СН3СООН →…
2) FeSO4 + КОН →…
3) NaHCO3 + HBr →…
4) Pl(NO3)2 + Na2S →…
20. Краткое ионное уравнение ОН‑ + Н+ = Н2O отвечает взаимодействию
1) Fe(OH)2 + НCl →…
2) NaOH + HNO2 →…
3) NaOH + HNO3 →…
4) Ва(ОН)2 + KHSO4 →…
21. В ионном уравнении реакции
SO2 + 2OН = SO32‑ + Н2O
ион ОН‑ может отвечать реагенту
1) Cu(ОН)2
2) Н2O
3) LiOH
4) С6Н5ОН
22–23. Ионное уравнение
22. ЗСа2+ + 2РO43‑ = Са3(РO4)2↓
23. Са2+ + НРO42‑ = СаНРO4↓
соответствует реакции между
1) Са(ОН)2 и К3РO4
2) СаCl2 и NaH2PO4
3) Са(ОН)2 и Н3РО4
4) СаCl и К2НРO4
24–27. В молекулярном уравнении реакции
24. Na3PO4 + AgNO3 →…
25. Na2S + Cu(NO3)2 →…
26. Ca(HSO3)2 [p‑p, t] →…
27. K2SO3 + 2HBr →… сумма коэффициентов равна
1) 4
2) 5
3) 7
4) 8
28–29. Для реакции полной нейтрализации
28. Fe(OH)2 + HI →…
29. Ва(ОН)2 + H2S →…
сумма коэффициентов в полном ионном уравнении составляет
1) 6
2) 8
3) 10
4) 12
30–33. В кратком ионном уравнении реакции
30. NaF + AlCl3 →…
31. К2СO3 + Sr(NO3)2 →…
32. Mgl2 + К3РO4 →…
33. Na2S + H2SO4 →…
сумма коэффициентов равна
1) 3
2) 4
3) 5
4) 6
34–36. В водном растворе соли
34. Са(ClO4)2
35. AgF
36. Fe2(SO4)3
образуется среда
1) кислотная
2) нейтральная
3) щелочная
4) любая
37. Концентрация гидроксид‑иона увеличивается после растворения в воде соли
1) CsNO3
2) SrCl2
3) NaCN
4) KHSO4
Смотрите также
Азотные,калийные,фосфорные удобрения
...
Значение химии в создании новых материалов, красителей и волокон
...
Характеристика стихийных бедствий
Землетрясения - это сильные колебания земной коры, вызываемые тектоническими или вулканическими причинами и приводящие к разрушению зданий, сооружений, пожарам и человеческим жертвам.
Важнейшая ...


