Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Обратимость реакцийCправочник по химии для подготовки к ЕГЭ / Химические реакции. Скорость, энергетика и обратимость / Cправочник по химии для подготовки к ЕГЭ / Химические реакции. Скорость, энергетика и обратимость / Обратимость реакций Обратимость реакцийСтраница 2
б) понижение
температуры (охлаждение):
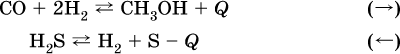
2. Давление.
Изменение давления оказывает влияние только на те системы, где хотя бы одно вещество находится в газообразном состоянии (твердые и жидкие вещества не учитываются, так как их собственный объем весьма мал по сравнению с объемом газов и паров).
Увеличениедавления в обратимой реакции смещает равновесие с сторону процесса, идущего с уменьшением количества газообразных веществ, т. е. с уменьшениемобъема, а уменьшение давления – в сторону увеличения количества газообразных веществ, т. е. с увеличением
объема:
а)
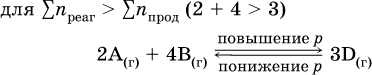
б)
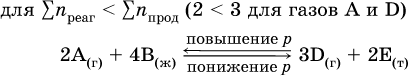
При Σnреаг = Σnпрод изменение не вызовет смещения равновесия.
Примерыгомогенных реакций:
а) увеличение
давления (сжатие):
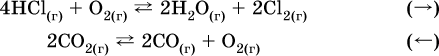
б) уменьшение
давления (расширение):
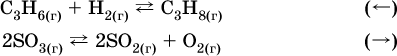
Примерыгетерогенных реакций (коэффициенты перед формулами конденсированных веществ не учитываются):
а) увеличение
давления (сжатие):
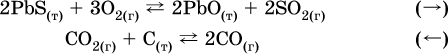
б) уменьшение
давления (расширение):
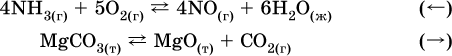
В реакциях с равными количествами газообразных реагентов и продуктов (здесь 2 = 2 в обоих примерах):
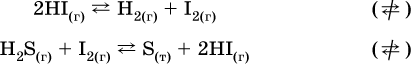
сдвиг равновесия наблюдаться не будет.
3. Концентрация.
При увеличении
концентрации одного из газообразных веществ (реагента или продукта), находящегося в равновесной системе, равновесие смещается в сторону расхода данного вещества. При уменьшенииконцентрации этого вещества равновесие смещается в сторону образованияданного вещества. Изменение содержания твердых и жидких веществ не влияет на состояние равновесия.
Для некоторой реакции:
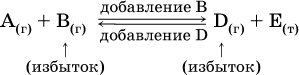
Смещение равновесия вправо можно было вызвать добавлением избытка реагента А (вместо В), а смещение влево возможно только избытком продукта D (другой продукт – твердое вещество).
Этот вывод следует непосредственно из равновесного закона действующих масс:
![]()
При добавлении в систему газа D равновесие сместится влево т. е. при протекании обратной реакции так увеличится содержание газов А и В, что соотношение концентраций останется постоянным и равным Кс. Отметим еще раз, что добавление конденсированного вещества (здесь твердого Е) не повлияет на состояние равновесия (сдвиг равновесия добавлением Е невозможен).
Примеры:
а) при добавлении аммиака равновесие сместится вправо:
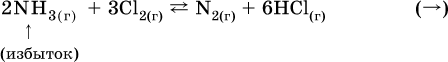
б) при добавлении водорода равновесие сместится влево:
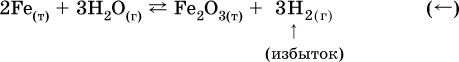
Примеры заданий части А
1. Гетерогенные реакции – это
1) Н2 + I2(г) → HI
2) Fe2(SO4)3(т) → Fe2O3(T) + SO3
3) Zn + H2SO4 → ZnSO4 + H2↑
4) CO + H2 → CO + H2O (nap)
2. При взаимодействии H2 с Cl2, Br2 и I2 в сосудах равного объема через 27 с образуется по 0,04 моль продуктов. Скорость реакции
1) выше для I2
2) выше для Cl2
3) одинакова
4) выше для Br2
3. Для гомогенной реакции А + В →… при одновременном увеличении молярной концентрации исходных веществ в 3 раза скорость реакции возрастет
1) в 2 раза
2) в 3 раза
3) в 6 раз
4) в 9 раз
4–6. Скорость реакции
4. 2CuО(т) + СО →…
5. 2FeO(т) + С(т) →…
6. N2 + 2С(т) + Н2 →…
при V = const и увеличении количества веществ в 4 раза изменится так:
1) возрастет в 4 раза
Смотрите также
Полный расчет ректификационной колонны
Задание на проектирование
Перечень инженерных расчетов: расчет ректификационной колонны;
подробный тепловой расчет дефлегматора; ориентировочный расчет теплообменников.
Перечень раб ...
Получение метилового эфира монохлоруксусной кислоты
...
Анализ технологического процесса схемы переэтерификации диметилового эфира цианоэтилфосфоновой кислоты моноэтиленгликоль (мет) акрилатом
История развития
человечества - это прежде всего история изобретения, создания и
совершенствования различных изделий и технологий, другими словами - процесса
инженерного творчества (ИТ). Ре ...


