Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ХромCправочник по химии для подготовки к ЕГЭ / Переходные металлы 4‑го периода. Свойства, способы получения.
Общие свойства металлов / Cправочник по химии для подготовки к ЕГЭ / Переходные металлы 4‑го периода. Свойства, способы получения.
Общие свойства металлов / Хром ХромСтраница 1
Хром – элемент 4‑го периода и VIБ‑группы Периодической системы, порядковый номер 24. Электронная формула атома [18Ar]3d54s1, характерные степени окисления +VI, + III и 0.
Шкала степеней окисления хрома:
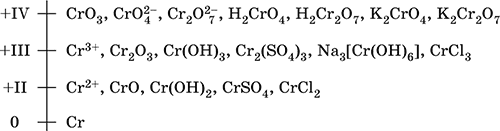
По электроотрицательности (1,56) хром занимает промежуточное положение между типичными металлами (Na, К, Са) и типичными неметаллами (F, О, N. CI, S). Соединения CrIII проявляют амфотерные свойства, металлические (основные) свойства преобладают у CrII, неметаллические (кислотные) – у CrVI; в соединениях хром чаще находится в составе катионов и реже – в составе анионов. Хром образует многочисленные соли и бинарные соединения.
В природе – девятнадцатый
по химической распространенности элемент (десятый среди металлов), находится только в виде соединений (минералы, полиметаллические руды). Растворимые соли хрома ядовиты.
Хром Cr.
Серый (с голубоватым оттенком) металл, очень твердый, ковкий (технический продукт – хрупкий). Блестящий, хотя покрыт очень тонкой оксидной пленкой, сохраняет блеск даже во влажном воздухе. Не реагирует с водой, щелочами и гидратом аммиака, пассивируется в концентрированной и разбавленной азотной кислоте и в «царской водке».
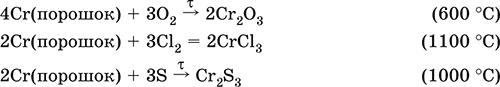
В ряду напряжений стоит левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород:
Cr + 2H+ = Cr2+ + Н2↓
Далее катион Cr2+ можно перевести кислотами‑окислителями в катион Cr3+:
![]()
Хром реагирует в расплаве с сильными окислителями:
2Cr + КClO3 = Cr2O3 + КCl (500–700 °C)
2Cr + 3KNO3 = Cr2O3 + 3KNO2 (400–550 °C)
Получение хрома в промышленности – алюминотермия:
Cr2O3 + 2Al = 2Cr + Al2O3 (800 °C)
и электролиз раствора:
![]()
Промышленно важен сплав хрома с железом – феррохром (6O–85 % хрома), его производят восстановлением оксидов, например минерала хромит:
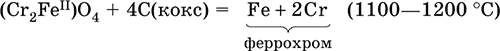
Применяется хром для создания защитных покрытий на других металлах (хромирование), как компонент механически прочных и коррозионно‑стойких сталей.
Гидроксид хрома (III) Cr(ОН)3.
Амфотерный гидроксид. Серо‑зеленый, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид CrО(ОН). Не растворяется в воде. Из раствора осаждается в виде серо‑голубого и голубовато‑зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака. Применяется для синтеза соединений хрома (III).
Уравнения важнейших реакций:
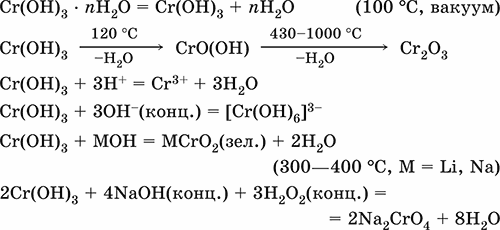
Получение: осаждение гидратом аммиака из растора солей хрома(III):
Cr3+ + 3(NH3 Н2O) = Cr(OH)3
↓ + 3NH4+
Хромат калия К2CrO4.
Оксосоль. Желтый, негигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде (желтая
окраска раствора отвечает иону CrO42‑), незначительно гидролизуется по аниону. В кислотной среде переходит в К2Cr2O7. Окислитель (более слабый, чем К2Cr2O7). Вступает в реакции ионного обмена.
Качественная реакция на ион CrO42‑ – выпадение желтого осадка хромата бария, разлагающегося в сильнокислотной среде. Применяется как протрава при крашении тканей, дубитель кож, селективный окислитель, реактив в аналитической химии.
Уравнения важнейших реакций:
2К2CrO4 + H2SO4 (30 %) = К2Cr2O7 + K2SO4 + Н2O
2К2CrO4(т) + 16HCl (конц., гор.) = 2CrCl3 + ЗCl3↑ + 8H2O + 4КCl
2К2CrO4 + 2H2O + 3H2S = 2Cr(OH)3↓ + 3S↓ + 4KOH
2К2CrO4 + 8H2O + 3K2S = 2K3[Cr(OH)6] + 3S↓ + 4KOH
2К2CrO4 + 2AgNO3 = 2KNO3 + Ag2CrO4 (красн.)↓
Качественная реакция:
К2CrO4 + ВаCl2 = 2КCl + ВаCrO4↓
2BaCrO4(т) + 2HCl (разб.) = ВаCr2O7(р) + ВаCl2 + Н2O
Получение: спекание хромита с поташом на воздухе:
4(Cr2FeII)O4 + 8К2СO3 + 7O2 = 8К2CrO4 + 2Fe2O3 + 8СO2 (1000 °C)
Дихромат калия К2Cr2O7.
Оксосоль. Техническое название хромпик. Оранжево‑красный, негигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (оранжевая
окраска раствора отвечает иону Cr2O72‑). В щелочной среде образует К2CrO4. Типичный окислитель в растворе и при сплавлении. Вступает в реакции ионного обмена.
Смотрите также
Проблемы и решения на уровне структурной химии
В данном разделе
речь идет об особом уровне развития химических знаний, на котором
главенствующую роль играет структура молекулы реагента.
Свойства веществ,
и их качественное разнообразие, обусл ...
Витанолиды, их химическая природа
...
Введение
Процессы ректификации являются одними из самых энергоемких
процессов химической технологии, и их эффективность часто определяет экономику
производства в целом. В ряде случаев на разделение методом р ...


