Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Дисперсная системаСтатьи и работы по химии / Статьи и работы по химии / Дисперсная система Дисперсная системаСтраница 4
Адсорбция кислорода на поверхности мелких порошков и аэрозолей в ряде случаев может приводить к резкому ускорению процесса окисления дисперсной фазы, что может стать причиной самовозгорания и даже взрыва, например, мелкодисперсной муки, мучной, сахарной пыли и т. п. Ионная адсорбция может быть обратимой или необратимой. Обратимая адсорбция является основой ионообменной хроматографии. Прием в Екатеринбурге туристов uva-tour.com.
Газовая хроматография может быть разделена на газо-адсорбционную (газо-твердую) и газо-жидкостную. В первом случае неподвижной фазой служит твердое вещество — адсорбент, во втором — жидкость, распределенная тонким слоем по поверхности какого-либо твердого носителя (зерненого материала, стенок колонки).
82. В каком объемном соотношении следует смешать 0,029 %-ный раствор NaCl и 0,001 н раствор AgNO3, чтобы получить незаряженные частицы золя AgCl? Плотность раствора NaCl равна 1 г/мл.
Решение. Запишем уравнение реакции:
NaCl + AgNO3 = AgCl + NaNO3
0,029 0,001 н.
Запишем формулу мицеллы: [m (AgСl) n Cl– · (n-1) Ag+]1– x Ag+
Для того, чтобы ее получить, следует взять в избытке раствор NaCl.
Исходя из формулы %-ной концентрации вещества можно записать, что:
![]()
Для того, чтобы определить массу растворенного нитрата серебра, воспользуемся формулой:
![]()
Откуда масса вещества AgNO3 равна:
![]()
По уравнению масса хлорида натрия:
х_-------------------------107 г.
58 г/моль------------------107г/моль
х=58 г
Объем раствора хлорида натрия:
![]()
Объем раствора нитрата серебра
2000, 42 мл----------------------------х мл
58 г/моль 107 г/моль
х = 2000, 42*107 /58 = 3690,43 мл
Соотношение объемов веществ:![]()
98. Коагуляция дисперсной системы. Скорость коагуляции. Причины, вызывающие процесс самопроизвольной коагуляции.
Коагуляция – процесс самопроизвольного укрупнения (слипания) дисперсных частиц, который может происходить при действии на дисперсную систему различных факторов: при интенсивном перемешивании или встряхивании, нагреве или охлаждении, облучении светом или пропускании электрического тока, при добавлении к системе электролитов или неэлектролитов и др. При разных способах воздействия на систему происходит уменьшение энергии связи диспергированных частиц с окружающей их дисперсионной средой. Так, добавление электролита вызывает сжатие диффузного слоя в коллоидной частице, следовательно, понижение величины электрокинетического потенциала. Это приводит к уменьшению электростатического отталкивания коллоидных частиц и, как следствие, к большей вероятности их слипания.
Минимальная концентрация электролита, добавляемого к дисперсной системе, при которой наступает явная коагуляция за определенный промежуток времени, носит название порога коагуляции ![]() . Порог коагуляции определяется температурой, природой добавленного электролита, знаком заряда добавляемого иона (действует прежде всего ион, имеющий заряд, противоположный заряду коллоидных частиц) и величиной заряда этого иона. Так, для трех-, двух- и однозарядных ионов явная коагуляция наступает при концентрации электролитов в соотношении 1:10 - 50: 500-1000 (приближенное правило Шульце-Гарди).
. Порог коагуляции определяется температурой, природой добавленного электролита, знаком заряда добавляемого иона (действует прежде всего ион, имеющий заряд, противоположный заряду коллоидных частиц) и величиной заряда этого иона. Так, для трех-, двух- и однозарядных ионов явная коагуляция наступает при концентрации электролитов в соотношении 1:10 - 50: 500-1000 (приближенное правило Шульце-Гарди).
Порог коагуляции рассчитывается следующим образом:
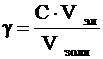 , (1)
, (1)
где g - порог коагуляции, кмоль/м3;
С – молярная концентрация раствора электролита, кмоль/м3;
Vэл – объем раствора электролита, м3;
Vзоля – объем золя, м3.
Теорию быстрой скорости коагуляции разработал Смолуховский. Он автор уравнения для расчета константы скорости коагуляции K:
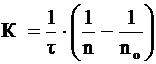 , (2)
, (2)
где n0 и n – число частиц в единице объема системы до начала коагуляции и к моменту времени ![]() соответственно;
соответственно;
Смотрите также
Введение.
Важнейшим
свойством ряда белков является их каталитическая активность. Вещества белковой
природы, способные каталитически ускорять химические реакции, называют
ферментами. Роль ферментов в жизнедея ...


