Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Дисперсная системаСтатьи и работы по химии / Статьи и работы по химии / Дисперсная система Дисперсная системаСтраница 1
2. Теплоты нейтрализации NaOH и NH4OH соляной кислотой соответственно равны – 55,9 кДж/моль и – 51,34 кДж/моль. Рассчитать теплоту диссоциации NH4OH.
![]() (1)
(1)
Сокращенное ионное уравнение: ![]() (2)
(2)
![]() (3)
(3)
Ионное уравнение: ![]() (4)
(4)
![]() (5)
(5)
Отнимаем уравнение 2 от уравнения 4 и получаем:
![]() (6)
(6)
![]() (7)
(7)
Ответ: 4,56 кДж.
17. При температуре 298 К реакция заканчивается через 2,5 ч. Рассчитать, при какой температуре она закончится через 20 мин., если температурный коэффициент реакции равен 3.
Решение.
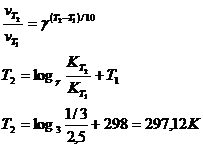 Ответ: 297 К
Ответ: 297 К
22. Рассчитать максимальное количество фаз, которые могут сосуществовать в различных системах, состоящих только из молекул Н2О. Понятие тройной точки на диаграмме состояния воды.
В соответствии с правилом фаз Гиббса для равновесной гетерогенной системы число фаз плюс число степеней свободы равно числу компонентов плюс два:
Ф + С = К + 2.
число фаз Ф= К+2-С
Для воды: Ф=2+2-1=3
Понятие тройной точки на диаграмме состояния воды:
В тройной точке на диаграмме состояния воды находится равновесное состояние всех трех фаз. Если в других точках параметры системы можно изменять, то в точке равновесия фаз этого делать нельзя, так число степеней свободы в этой точке равно нулю.
42. Удельная и эквивалентная электропроводность раствора, их взаимосвязь и зависимость от степени и константы диссоциации электролита.
Электропроводность (способность проводить ток под действием постоянного электрического поля) растворов электролитов обусловлена переносом вещества (направленным движением ионов) и его химическими превращениями. В этом случае раствор называется проводником второго рода. Электропроводность такого раствора зависит прежде всего от природы электролита (от подвижности ионов), его концентрации в растворе, вязкости и температуры самого раствора и др. В проводниках первого рода (к ним относятся преимущественно металлы) переноса вещества не происходит.
Удельная электропроводность – величина, обратная удельному сопротивлению:
![]() ,
,
где c - удельная электрическая проводимость, Ом – 1.см – 1;
ρ – удельное электрическое сопротивление, Ом · см.
Эквивалентная электропроводность – величина электропроводности, отнесенная к одному моль – эквиваленту электролита:
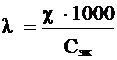 ,
,
где λ – эквивалентная электропроводимость, Ом – 1 · см2 · моль– 1;
Сэк – молярная концентрация эквивалентов раствора электролита, моль/л.
Эквивалентная электропроводность зависит от подвижности анионов и катионов и возрастает с увеличением разбавления, достигая предельного значения в бесконечно разбавленном растворе. В этом случае
l ¥ = Lo– + Lo+,
где ![]() – эквивалентная электропроводность в бесконечно разбавленном растворе, Ом – 1 см2 моль– 1; Lо+ и Lо– – предельные подвижности ионов (эквивалентные электроподвижности катиона и аниона при бесконечном разбавлении), Ом – 1 · см2.
– эквивалентная электропроводность в бесконечно разбавленном растворе, Ом – 1 см2 моль– 1; Lо+ и Lо– – предельные подвижности ионов (эквивалентные электроподвижности катиона и аниона при бесконечном разбавлении), Ом – 1 · см2.
Уравнение представляет собой эмпирический закон Кольрауша: эквивалентная электропроводность при бесконечном разбавлении равна сумме предельных электроподвижностей ионов.
Эквивалентная электропроводность зависит также от степени диссоциации и константы диссоциации электролита, которые связаны уравнениями:
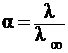 ,
,
где α – степень диссоциации электролита,
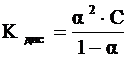 ,
,
Смотрите также
Обсуждение результатов
Полученные ранее на кафедре ХТООС МИТХТ им. М.В.Ломоносова
данные [25, 26] показывают, что в системах KI - PdI2 –
фенилацетилен (ФА) и KI - PdI2 – метилацетилен (МА) наблюдаются
развитые релаксацио ...
Развитие алхимии
...
Термический анализ
Метод исследования
физико-химических и химических превращений, происходящих в минералах и горных
породах в условиях заданного изменения температуры. Термический анализ
позволяет идентифицировать от ...


