Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Индивидуальное заданиеСтатьи и работы по химии / Гомогенное химическое равновесие / Статьи и работы по химии / Гомогенное химическое равновесие / Индивидуальное задание Индивидуальное заданиеСтраница 2
Используя уравнение:
![]()
Δn- изменение числа молей газообразного конечного и начального продуктов реакции.
Кр и парц. давления выражены в н/м2.
и ур-ние ![]() определим значение
определим значение ![]() реакции:
реакции:
![]()
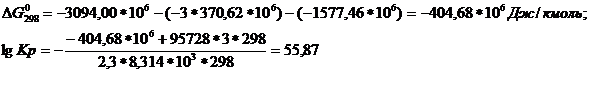
Ответ.lg Kp=55,87.
№2
В данной реакции ΔV=2-3=-1, поэтому выражение для Кх примет вид:
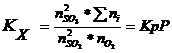
Из уравнения видно, что с увеличением давления р увеличивается константа равновесия Кх, поскольку Кр не зависит от давления. Увеличение Кх произойдёт за счёт увеличения числителя и за счёт уменьшения знаменателя. При отсутствии инертной примеси азота ![]() равна сумме молей веществ в равновесной смеси, которая при смещении равновесия изменяется незначительно, поэтому числитель увеличивается в основном за счёт увеличения
равна сумме молей веществ в равновесной смеси, которая при смещении равновесия изменяется незначительно, поэтому числитель увеличивается в основном за счёт увеличения ![]() ; одновременно должны уменьшатся
; одновременно должны уменьшатся ![]() и
и ![]() в знаменателе. Отсюда делаем вывод, что с ростом давления р в равновесной системе кол-во SO3 возрастает, равновесие сдвинется вправо, выход серного ангидрида увеличится. С увеличением кол-ва азота увеличивается сумма
в знаменателе. Отсюда делаем вывод, что с ростом давления р в равновесной системе кол-во SO3 возрастает, равновесие сдвинется вправо, выход серного ангидрида увеличится. С увеличением кол-ва азота увеличивается сумма ![]() , что влечёт за собой уменьшение
, что влечёт за собой уменьшение ![]() . Равновесие сдвинется влево, выход SO3 уменьшится.
. Равновесие сдвинется влево, выход SO3 уменьшится.
Принципа смещения равновесия Ле Шателье приводит с к следующим качественным выводам. Т.к. реакция образования SO3 из SO2 и O2 идёт с уменьшением объёма, то при увеличении давления, т.е. при сжатии реагирующей смеси, процессом ослабляющим сжатие, будет процесс, приводящий к уменьшению числа молекул в реагирующей смеси. Таким образом, при увеличении давлении реакция сдвинется слева на право и выход SO3 возрастёт.
Увеличение содержания азота при постоянном общем давлении ведёт к разбавлению реагирующей смеси, что равноценно уменьшению давления при отсутствии азота, т.е. приведёт к сдвигу равновесия справа налево, выход то равноценно уменьшению давления при отсутствии азота, ведёт к разбавлению реагирующей смесию числа молекул в реагирующей с SO3 уменьшится.
№3
Реакция протекает по уравнению:
H2+I2 ![]() 2HI
2HI
Константа равновесия этой реакции может быть выражена уравнением:
![]()
Для определения величины константы равновесия необходимо определить состав равновесной газовой смеси.
H2 и I2 реагируют с образованием HI, то в равновесной смеси исходное кол-во будет меньше, чем в исходной.
Исходная концентрация H2 и I2 :
![]()
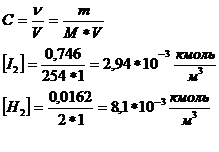
Конц. получ. HI в равновесной смеси:
![]()
Реакция протекает при постоянном давлении, тогда:
H2+I2 ![]() 2HI
2HI
1кмоль 1кмоль 2кмоль
(2,82кмоль 2,82 кмоль 5,64 кмоль)*10-3![]()
Смотрите также
Процесс компаундирования нефтепродуктов
Промышленное
производство
нефтепродуктов состоит из следующих основных этапов: первичная, вторичная
переработка нефти и процессы смешения (компаундирования).
Первичная
переработка
(пря ...
Получение серной кислоты путем переработки отходов производства диоксида титана
Сернокислотный
метод производства диоксида титана из ильменита и титановых шлаков имеет ряд
существенных недостатков — сложная многостадийная схема, высокий расход серной
кислоты, значитель ...
Исследование свойств продуктов циклизации алициклического 1,5,9-трикетона
Алициклические
1,5,9-трикетоны – малоизученный класс соединений, хотя первые сведения о них
появились еще в 50-х годах прошлого века. Наличие нескольких реакционных
центров делают трикетоны ...


